癌症免疫治疗正以前所未有的速度重塑肿瘤治疗格局。从检查点抑制剂到CAR-T细胞疗法,再到新兴的核酸药物,科学家们不断探索激活人体自身免疫系统以精准清除癌细胞的新路径。近期,中新康明通过研究揭示:脂质纳米颗粒(Lipid Nanoparticles, LNPs)递送的质粒DNA(pDNA)可作为一种强效、稳定的免疫调节剂,在不依赖编码免疫刺激蛋白的情况下,通过激活干扰素信号通路显著抑制肿瘤生长。这一发现不仅为非病毒载体介导的癌症免疫治疗开辟了全新方向,也为LNP技术在更广泛治疗领域的应用提供了坚实科学依据。
作为国内领先的创新药物CDMO服务商,中新康明高度关注并深度布局LNP核酸递送领域,致力于为全球科研机构与生物技术公司提供从关键原料供应到制剂开发的一站式解决方案,加速此类前沿免疫疗法的研发进程。
1. 核心原料稳定供应,保障研发源头质量
中新康明现已实现非GMP级别LNP核心脂质的规模化、高纯度生产,包括:
SM-102:经验证的高效可电离脂质,具备优异的内体逃逸能力与低毒性特征;
DMG-PEG(2000):关键PEG化脂质,有效调控LNP粒径、提升胶体稳定性并延长体内循环时间;
DSPC(1,2-二硬脂酰-sn-甘油-3-磷酸胆碱):结构磷脂,维持LNP双层膜结构完整性。
所有原料均提供完整质检报告(COA),批次间一致性高,可满足早期筛选、药效验证及临床前研究需求。
2. 全流程LNP CDMO服务,覆盖“设计-制备-表征”全链条
依托先进的微流控混合平台与严格的质量控制体系,中新康明提供:
LNP处方定制与工艺开发:基于客户核酸类型(pDNA、mRNA、siRNA等)优化脂质比例与工艺参数;
LNP制剂合成:采用精密微流控技术确保粒径均一(PDI < 0.2)、高包封率(>90%);
全面理化与功能表征:包括动态光散射(DLS)测粒径与PDI、荧光/UV法测包封率、凝胶电泳验证核酸完整性、体外转染效率评估(如荧光素酶报告基因检测)等。
3. 技术优势:精准、高效、合规
中新康明在LNP CDMO服务中具备三大核心优势:
平台化技术积累:已成功交付数百批次LNP项目,涵盖疫苗、肿瘤免疫、基因编辑等多个领域;
快速响应能力:从原料采购到成品交付周期短,支持紧急科研需求;
数据完整性与可追溯性:所有检测数据符合GLP规范,为IND申报提供可靠支持。
参考文献:“Lipid nanoparticle-formulated DNA acts as a potent immune modulator for cancer immunotherapy through interferon signaling pathways”
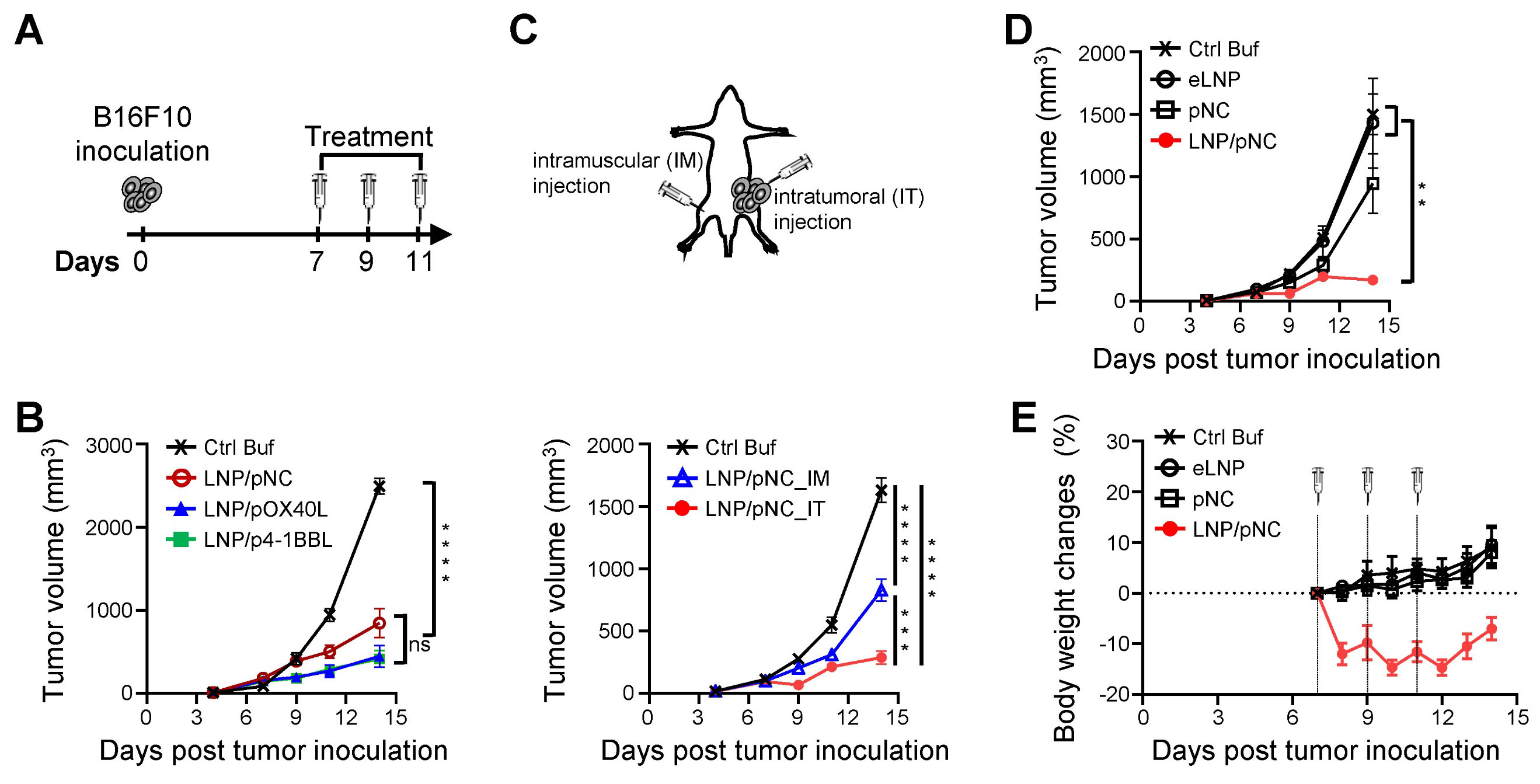
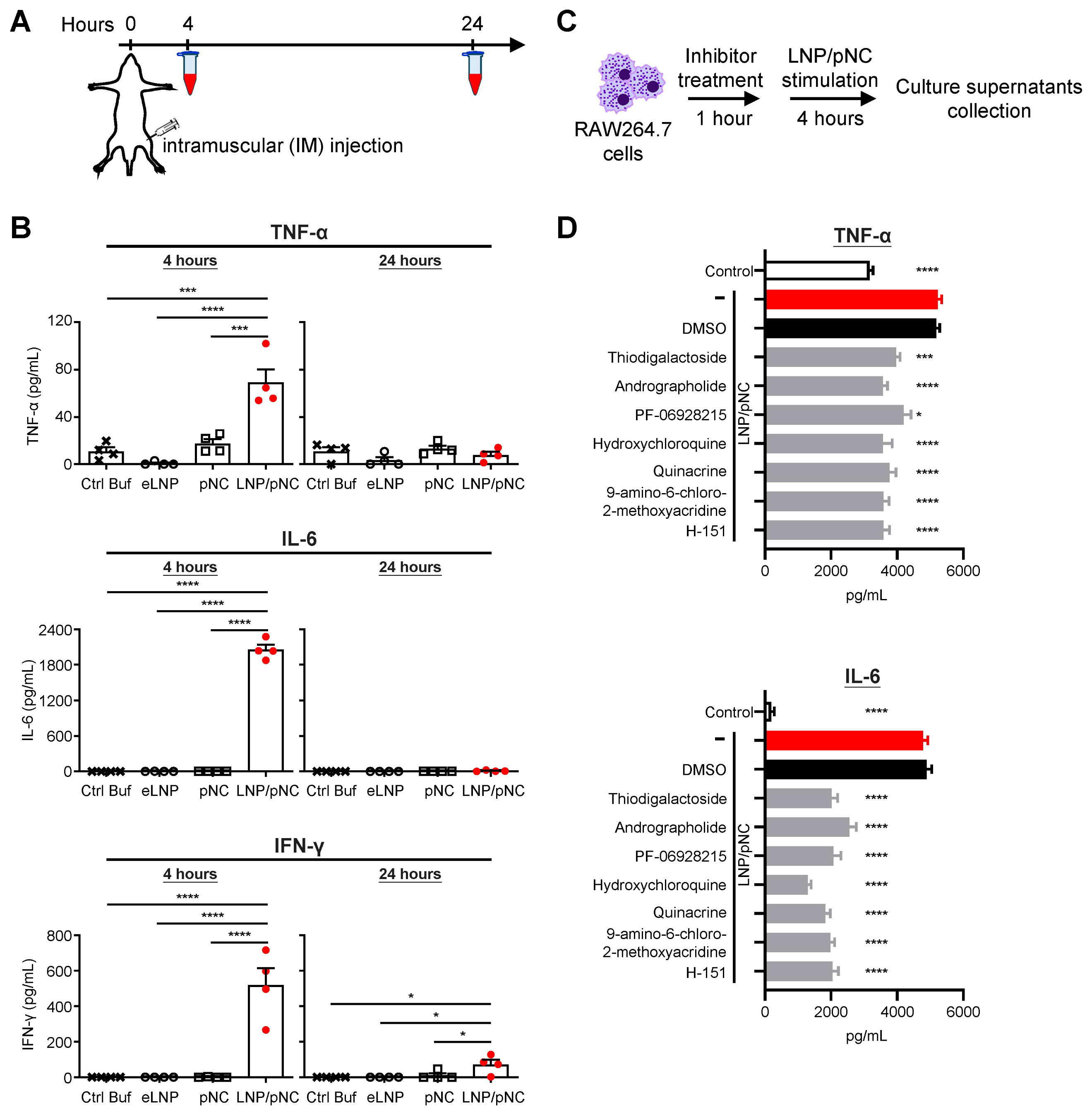
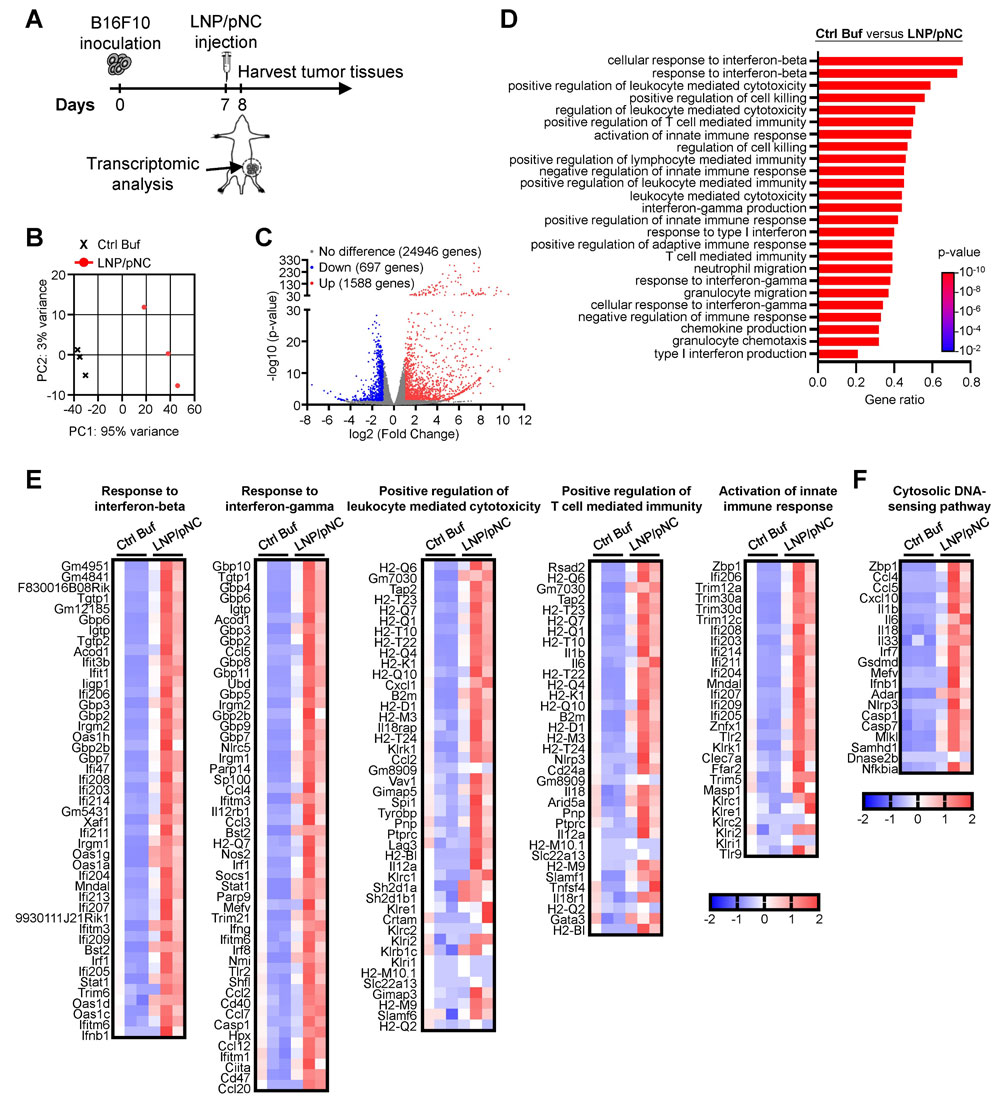
文献引用:结果:LNP/pDNA药剂在长时间储存后仍能保持封装效率和尺寸的一致性,并能实现有效的基因传递。无论是肿瘤内注射还是肌肉注射,都能抑制肿瘤生长,其中局部给药的效果更为显著。LNP/pDNA激活了细胞内的DNA感应通路,并诱导了强大的促炎性细胞因子的产生。转录组分析显示,存在强烈的I型和II型干扰素反应以及免疫效应通路的上调。缺失实验证实,抗肿瘤效果依赖于CD8⁺T细胞和NK细胞,但与中性粒细胞和单核细胞无关。值得注意的是,在TLR9缺陷型小鼠中治疗效果得以保留,但在同时缺乏I型和II型干扰素信号传导的小鼠中则丧失了这种效果。结论:LNP/pDNA通过激活依赖于干扰素、不依赖于TLR9的通路,以及结合先天和适应性免疫反应,诱导了强大的抗肿瘤免疫反应。这些发现支持LNP/pDNA作为一种稳定且有效的癌症免疫治疗平台。
4. 成功案例:赋能前沿免疫疗法开发
近期,中新康明为某药企研发团队提供了全套LNP/pDNA CDMO服务。我们为其定制合成了含SM-102/DSPC/Chol/DMG-PEG的LNP,并完成粒径(88.5 nm)、PDI(0.12)、包封率(94.7%)及体外转染验证。制剂在小鼠模型中成功复现了显著的肿瘤抑制效应与干扰素应答,有力支撑了后期的临床研究的转换。此案例充分体现了中新康明在复杂核酸递送系统开发中的技术实力与协作深度。
5. 综合CDMO服务:不止于LNP,更在于赋能创新
中新康明始终秉持“以客户研发成功为中心” 的理念,构建了覆盖小分子、多肽、核酸药物及先进递送系统的综合CDMO平台。中新康明深知,每一项突破性研究的背后,都离不开稳定、可靠的物料与技术服务支撑。中新康明将持续投入技术创新,优化服务流程,成为您值得信赖的长期合作伙伴,共同推动下一代癌症免疫疗法从实验室走向临床,惠及全球患者。
注:本文提及的SM-102、DMG-PEG(2000)、DSPC等产品目前以非GMP级别供应,适用于科研与临床前研究。GMP级别产品可根据客户需求定制开发。
 返回
返回