胶质瘤是中枢神经系统最具侵袭性的原发性恶性肿瘤,其血脑屏障(BBB)限制、肿瘤异质性及免疫抑制微环境极大阻碍了传统化疗药物的疗效。脂质体作为成熟的纳米递送系统,凭借其良好的生物相容性、可调控的粒径、长循环特性及表面功能化潜力,已成为突破BBB、实现胶质瘤靶向治疗的关键策略。中新康明提供脂质体、LNP纳米粒、水凝胶、微球等主流递送系统的全流程开发服务。聚焦治疗胶质瘤的脂质体配方研究,依托自主脂质库、多模态制备平台与完整的生物学评价体系,提供从处方设计、工艺开发、冻干优化到体内外药效/毒理验证的全流程服务,助力客户加速抗胶质瘤创新药物的临床转化。
一、胶质瘤治疗脂质体的定制化配方开发
(1)脂质体配方开发(含脂质/药物比例、包封效率、粒径调控与稳定性处方设计)
基于目标药物(如紫杉醇、多柔比星、SN-38或siRNA/mRNA等)的理化性质(亲脂性、pKa、分子量、电荷)及治疗需求(如穿透血脑屏障、肿瘤靶向、缓释),系统设计四元或多元脂质体系。典型组分包括:
主磷脂:如DSPC(高相变温度,提升膜稳定性);
胆固醇:调节膜流动性,增强血清稳定性,通常占比30–45 mol%;
PEG化脂质:如DSPE-PEG2000(2–5 mol%),延长循环半衰期,减少MPS清除;
功能脂质(可选):如DOTAP(阳离子,提升核酸包封)、pH敏感脂质(如DOPE)或可降解脂质。
通过正交实验或DoE(实验设计)方法,系统考察不同脂质摩尔比、药物/脂质质量比(D/L ratio)对包封率(目标 >85%)、载药量、粒径(目标80–120 nm)及储存稳定性的影响,最终确定高稳健性基础处方。
(2)初步工艺摸索:薄膜分散法、乙醇注入法、微流控法
根据药物溶解性、生产规模及GMP兼容性,评估三种主流制备工艺的适用性:
薄膜分散法:
将脂质溶于有机溶剂(如氯仿),旋转蒸发成膜后水化。适用于实验室小试(<10 mL),操作简单,但批次重现性较差,残留溶剂需严格控制。
乙醇注入法:
将脂质乙醇溶液快速注入水相(含药物或缓冲液),自发形成纳米粒。适合中等规模(10–100 mL),粒径可控性优于薄膜法,但需优化注入速率与搅拌强度以避免聚集。
微流控技术(芯片式/台式):
通过精确控制水相与有机相的流速比(FRR)和总流速(TFR),实现毫秒级混合,获得高度均一(PDI < 0.15)、可放大(mL至L级)的脂质体。尤其适用于mRNA/siRNA-LNP或需严格粒径控制的靶向制剂。
初步筛选阶段将对三种方法在粒径分布、包封率、工艺稳健性及可放大性方面进行横向对比,推荐最优路径进入下一阶段。
(3)配方关键指标优化:粒径、Zeta电位、包封率、药物释放行为与稳定性
在确定基础处方与工艺后,聚焦以下关键质量属性(CQAs)进行精细化调控:
粒径:通过调节脂质浓度、水化体积、均质压力(如使用高压均质机)或微流控FRR,将粒径精准控制在80–120 nm区间,以兼顾EPR效应与BBB穿透潜力;
Zeta电位:目标为-10 mV至+15 mV。过高正电易致血清蛋白吸附与毒性,过负则影响细胞摄取。可通过调整DOTAP比例或表面PEG密度调控;
包封率:采用主动载药(如pH梯度法载DOX)或被动包封(疏水药物共溶于脂膜),结合超滤/HPLC测定,确保>85%;
药物释放曲线:在PBS(pH 7.4)及模拟肿瘤微环境(pH 5.5–6.5,含酯酶)中进行体外释放试验,评估是否具备缓释或响应性释放特性;
物理化学稳定性:监测4℃/25℃下1–4周内粒径漂移、聚集、药物泄漏等变化,筛选最稳定处方。
(4)处方稳定性研究:短期、冻融、光照与温度影响评估
为预测临床储存条件下的表现,开展多维度稳定性考察:
短期稳定性(2–4周):
在4℃(冷藏)、25℃(室温)条件下定期检测粒径、PDI、Zeta电位、包封率、外观(有无沉淀/分层)及pH值;
冻融稳定性:
模拟运输或使用过程中的冷冻-解冻循环(通常3次:-20℃ ↔ 25℃),评估复溶后粒径恢复率、包封保持率及是否出现不可逆聚集;
光照与高温影响:
参照ICH Q1B/Q1A指南,进行强光照射(5500 lux)及加速试验(40℃/75% RH),考察药物降解、脂质氧化及制剂外观变化;
血清稳定性(可选):
在含10–50%胎牛血清的培养基中孵育24–48 h,评估脂质体在生理环境中的结构完整性。
(5)冻干处方开发:保护剂筛选、比例优化与复溶性能验证
为实现长期常温或-20℃储存,开发稳定冻干粉针剂型:
冻干保护剂筛选:
对比蔗糖、海藻糖、甘露醇、右旋糖酐等常用保护剂对脂质体膜结构的保护效果。优选非还原性双糖(如海藻糖),因其玻璃化转变温度高、与磷脂头部基团形成氢键能力强;
保护剂/脂质比例优化:
通常保护剂浓度为5–10%(w/v),通过DSC(差示扫描量热)确定共晶点,优化预冻与升华参数;
复溶性能评估:
冻干后加入指定体积注射用水,轻柔振摇,要求:
复溶时间 ≤5 min;
粒径恢复率 ≥90%(vs. 冻干前);
包封率损失 ≤5%;
无可见颗粒或沉淀。
最终确定冻干工艺参数(预冻速率、一次干燥温度/真空度、二次干燥条件)及最优保护剂体系。
(6)处方优化与小试样品供应:提供高可行性候选配方及GMP-ready样品
整合前述研究数据,通过多目标优化(如兼顾高包封、小粒径、长循环、良好冻干性),筛选出1–3个高潜力候选处方。针对最优配方:
完成3批次小试重复性验证(n=3),确认工艺稳健性;
提供50–500 mg级(以药物计)的高质量小试样品,含完整COA(Certificate of Analysis),包括:
粒径、PDI、Zeta电位;
包封率、药物含量;
无菌、内毒素(如适用);
外观、pH、复溶性(冻干品);
同步交付详细处方组成、制备SOP及关键工艺参数,支持客户后续中试放大或IND申报。
二、中新康明提供覆盖从设计到生产的完整脂质体开发服务:
1:脂质体原辅料筛选:
(1):脂质辅料选择(DSPC、DSPE-PEG2000、胆固醇、DOTAP药用脂质DMF号、可追溯)
(2):脂质体类型选择:可长循环、靶向、控释或协同
(3):APIs原料药筛选(脂质体包封化药物(如 DOX、PTX、SN38)或核酸(siRNA/mRNA))
2:配方开发
(1):脂质体配方开发(包括脂质和药物比例、包封效率、粒径调控、稳定性处方设计)
(2):初步工艺摸索:薄膜法、乙醇注入法、微流控法
(3):配方指标优化:粒径、Zeta电位、包封率、药物释放曲线、稳定性
(4):处方稳定性研究:短期稳定性(2–4 周)、冻融稳定性、光照/温度影响
(5):冻干处方开发:冻干保护剂筛选、保护剂比例优化、复溶性/粒径恢复率
(6):处方优化和小试样品供应:提供最适合的小试样品及配方
3:配方脂质体系统验证与生物学评价:(生物学&体内体外)
(1):体外实验:细胞摄取率、转染效率、细胞毒性
(2):体内实验:小动物药代动力学(PK)、药效(PD)、生物分布、毒理
(3):影像追踪:利用你们荧光探针/标记分子,做体内分布成像
4:脂质体配方的工艺开发及中试放大
(1):工艺路线选择(根据药物的性质和生产规模,选择合适的脂质体制备工艺)
(2):工艺参数优化(高压均质、溶剂注入速率、剪切速率)
(3):无菌工艺与纯化(脂质体制剂需要进行无菌过滤,溶剂去除需要严格控制,确保脂质体中无有害溶剂残留)
(4):放大与中试(规模放大等效性:确认放大后的粒径、包封率等与小规模一致,放大后的脂质体稳定性和质量是否满足标准)
5:分析方法开发及验证:
(1):粒径与PDI测定:DLS(动态光散射)
(2):包封率分析:通常通过HPLC或LC-MS分析未包封药物和总药物的量,计算包封率
(3):表面电位:通过Zeta电位测定分析脂质体的表面电荷
(4):稳定性监测:监测脂质体的粒径变化、包封率等参数,以评估其长期稳定性。
6:稳定性研究和质量标准建立
(1):短期稳定性研究(短期稳定性研究主要评估脂质体在常规储存条件下一段时间内的质量变化):考察指标包括:粒径、包封率、外观、PH、粒子强度。
(2):长期稳定性研究:长期稳定性研究是通过模拟脂质体产品的长期储存条件来预测脂质体的实际保存情况。这通常包括以下:温度、湿度、光照、粒径、PDI、包封率、药物释放情况、外观变化、沉淀物、澄清物、药物析出分析
(3):加速稳定性研究:在更高温度和湿度条件下观察粒径变化、包封率变化、药物降解
(4):冻融稳定性研究:观察冻融后粒径恢复情况、包封率恢复情况、是否出现分层、沉淀等不良现象
(5):冻干稳定性研究:冻干过程可能对脂质体的稳定性造成影响,包括:重构后粒径的恢复、包封率和药物活性、稳定性
7:脂质体质量标准建立:
(1):外观与物理性质
(2):包封率与药物含量
(3):药物释放特性
(4):稳定性数据
(5):无菌性与内毒素
(6):生物相容性与生物活性
8:非GMP公斤级供应
中新康明提供服务质量标准的公斤级脂质体
三、中新康明的核心优势
✅ 专有脂质库:涵盖药用级DSPC、DSPE-PEG、DOTAP等,并具备DMF备案;
✅ 胶质瘤模型经验:已建立U87皮下/原位、GL261同源、PDX等多种模型验证体系;
✅ 靶向技术平台:成熟配体偶联工艺,支持Tf、Angiopep-2、T7等多路径验证;
✅ 全链条整合:从分子设计→冻干制剂→动物药效→CMC申报无缝衔接;
✅ 数据合规性:遵循GLP规范,所有原始数据可追溯,支持IND申报。
四、参考文献和文献引用
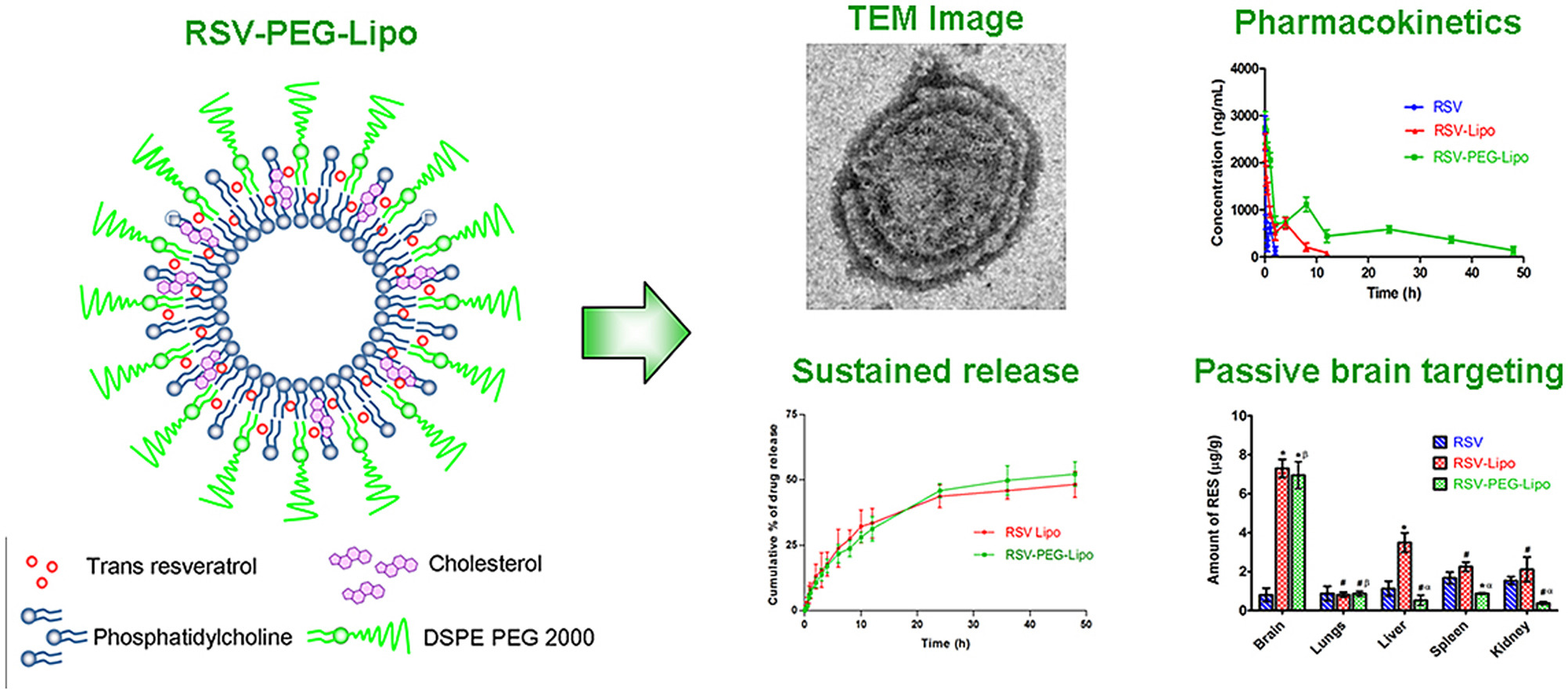
参考文献:“Trans resveratrol loaded DSPE-PEG2000 coated liposomes: An evidence for prolonged systemic circulation and passive brain targeting”
摘要翻译:白藜芦醇(RSV)是一种天然分子,已被证实具有心脏保护作用、血管舒张作用、抗炎作用、预防和治疗癌症的作用,且无任何潜在副作用。最近,其对神经胶质瘤细胞的抗癌潜力也得到了报道,并且其分子机制已得到证实。然而,由于RSV在体内循环中迅速消除,从而在哺乳动物体内生物半衰期较短,因此其在临床疾病管理中的治疗应用受到限制。因此,本研究的主要目的是使用DSPEPEG2000修饰(聚乙二醇化)脂质体来提高RSV的全身循环和生物半衰期。此外,还评估了RSV聚乙二醇化脂质体(RSV-PEG-Lipo)和非聚乙二醇化脂质体(RSV-Lipo)在脑内的分布情况,以证明其被动脑靶向能力。两种脂质体的体外药物释放均持续了48小时。RSV-PEG-Lipo显示出比原始RSV溶液和RSV-Lipo更高的曲线下面积、血浆半衰期和平均驻留时间,以及更低的分布容积和清除率。药代动力学结果清楚表明,RSV-PEG-Lipo将会是延长RSV血浆半衰期和延长其全身循环的有前景的工具。脑分布研究显示,脂质体制剂可用作有效的被动脑靶向工具,有助于治疗神经胶质瘤。
五、订购流程与服务须知
交付周期:基础处方开发 + 体外表征:30–60工作日;含原位胶质瘤模型药效验证:120–180工作日。
样品规格:提供10 mg至1 kg级脂质体冻干粉或液体,含完整COA报告。
包装运输:-20℃或-70℃冷链运输,铝箔袋/密封桶包装,全程温控记录。
验收标准:收货后7个工作日内依据合同指标及COA完成验收,异议需书面反馈并留样复测。
保密承诺:严格签署NDA,所有技术资料、实验数据及知识产权归客户所有。
突破血脑屏障,精准打击胶质瘤——选择中新康明,让您的抗脑瘤脂质体药物更快走向临床!
我们不仅是CDMO服务商,更是您值得信赖的中枢神经系统药物创新伙伴。
 返回
返回