猴痘是由猴痘病毒引起的人畜共患正痘病毒感染,近年来在全球多地暴发,被世界卫生组织(WHO)列为国际关注的突发公共卫生事件。尽管Tecovirimat等抗病毒药物已获批用于治疗,但其水溶性差、口服生物利用度低、组织分布受限等问题仍制约临床疗效。脂质体作为成熟的纳米递送平台,可显著提升抗病毒药物的溶解性、循环时间、靶向淋巴/皮肤/黏膜等病毒复制关键部位的能力,并潜在增强免疫调节效果。中新康明提供脂质体、LNP纳米粒、水凝胶、微球等主流递送系统的全流程开发服务。基于以上优势,中新康明聚焦抗猴痘病毒脂质体配方的筛选与鉴定,依托自主药用脂质库、多模态制备平台及病毒相关生物学评价体系,提供从处方设计、工艺开发、冻干优化到体外抗病毒活性与体内药效验证的全流程服务,助力客户加速高效、安全的抗猴痘病毒创新制剂研发。
一、抗猴痘病毒脂质体的定制化配方开发
(1)脂质体配方开发(含脂质/药物比例、包封效率、粒径调控与稳定性处方设计)
针对猴痘治疗需求,重点包载以下候选药物:
小分子抗病毒药:如Tecovirimat(ST-246)、cidofovir、brincidofovir(CMX001)等;
免疫调节剂:如TLR7/8激动剂、干扰素诱导剂;
核酸药物(探索性):靶向MPXV关键基因(如F13L、A29L)的siRNA或mRNA疫苗。
基于药物理化性质(如Tecovirimat为弱酸性、低水溶性),设计四元脂质体系:
主磷脂:DSPC(高相变温度,保障储存稳定性);
胆固醇:30–45 mol%,增强膜刚性,减少血清蛋白吸附;
PEG化脂质:DSPE-PEG2000(2–5 mol%),延长半衰期,促进淋巴结富集;
功能脂质(可选):如DOTAP(提升阳离子药物包封)、pH敏感脂质(DOPE)以促进内体逃逸。
通过DoE实验系统优化脂质摩尔比与药物/脂质质量比(D/L),目标实现:
包封率 >85%(尤其对疏水性Tecovirimat);
粒径 80–150 nm(利于淋巴引流与炎症组织渗透);
良好物理化学稳定性(4℃下≥4周)。

(2)初步工艺摸索:薄膜分散法、乙醇注入法、微流控法
根据药物溶解性与开发阶段,评估三种主流工艺:
薄膜分散法:适用于早期小试(<10 mL),操作简便,适合脂溶性药物共溶于膜中;
乙醇注入法:适合中试规模(10–100 mL),可实现快速自组装,需优化注入速率防止聚集;
微流控技术:推荐用于GMP路径开发,通过精确控制FRR/TFR,获得PDI < 0.15的均一制剂,尤其适用于需严格质量控制的抗病毒产品。
初步筛选将综合包封效率、粒径重现性、溶剂残留风险及放大潜力,确定最优工艺路线。
(3)配方关键指标优化:粒径、Zeta电位、包封率、释放行为与稳定性
聚焦以下关键质量属性(CQAs)进行精细化调控:
粒径:控制在80–150 nm,兼顾淋巴结靶向与炎症组织渗透;
Zeta电位:目标 -10 mV 至 +10 mV,避免非特异性清除;
包封率:对Tecovirimat等采用被动包封+主动载药(如远程装载)策略,确保>85%;
药物释放:在PBS(pH 7.4)及模拟感染微环境(pH 6.0–6.8)中评估缓释特性,避免突释;
稳定性:4℃/25℃下监测1–4周内粒径、包封率、外观变化,筛选最优处方。
(4)处方稳定性研究:短期、冻融、光照与温度影响评估
开展多维度稳定性考察,模拟真实储存与运输条件:
短期稳定性(2–4周):4℃/25℃下定期检测粒径、PDI、包封率、pH;
冻融稳定性:3次循环(-20℃ ↔ 25℃),评估复溶后性能恢复;
光照与高温:参照ICH指南,考察5500 lux光照及40℃/75% RH加速条件下药物降解与脂质氧化;
血清稳定性(可选):在含血清培养基中孵育,评估结构完整性。
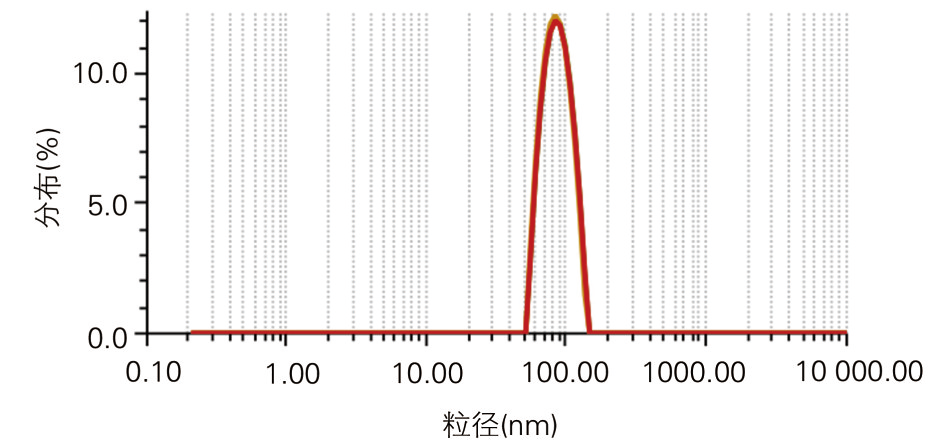
(5)冻干处方开发:保护剂筛选、比例优化与复溶性能验证
为支持全球分发与长期储备,开发冻干粉针剂型:
保护剂筛选:优选海藻糖或蔗糖(5–10% w/v),形成玻璃态保护脂质双层;
冻干工艺优化:通过DSC确定共晶点,优化预冻与干燥参数;
复溶要求:
复溶时间 ≤5 min;
粒径恢复率 ≥90%;
包封率损失 ≤5%;
无可见颗粒。
(6)处方优化与小试样品供应
整合数据,筛选1–3个高潜力候选配方,完成:
3批次重复性验证;
提供10–500 mg级(以药物计)小试样品;
配套完整COA(粒径、PDI、Zeta、包封率、药物含量、无菌、内毒素等);
交付处方组成、SOP及关键工艺参数,支持后续IND申报。
二、中新康明提供覆盖从设计到生产的完整脂质体开发服务
1.原辅料筛选
药用级脂质(DSPC、DSPE-PEG2000、胆固醇、DOTAP,具DMF备案);
脂质体类型:长循环、淋巴靶向、控释;
APIs适配:Tecovirimat、cidofovir、siRNA等。
2.配方开发
涵盖上述(1)–(6)全部环节。
3.生物学验证
体外:MPXV假病毒/活病毒抑制实验(Vero E6细胞)、细胞毒性(CC50)、治疗指数(TI = CC50/EC50);
体内:小鼠/仓鼠MPXV感染模型,评估病毒载量(qPCR)、病变评分、生存率;
分布成像:DiR/Cy7标记脂质体,追踪在淋巴结、皮肤、肺等靶器官的富集。
4.工艺开发与中试放大
工艺路线确认、参数优化、无菌过滤、溶剂残留控制;
放大至1–10 L,确保CQAs一致性。
5.分析方法开发与验证
DLS测粒径/PDI;
HPLC/LC-MS测包封率与药物含量;
Zeta电位、释放度、稳定性监测方法建立。
6.稳定性研究与质量标准建立
短期、长期、加速、冻融、冻干稳定性;
建立涵盖外观、含量、包封率、释放、无菌、内毒素的质量标准。
7.非GMP公斤级供应
可提供符合质量标准的公斤级脂质体,用于毒理或早期临床。
三、中新康明的核心优势
✅ 抗病毒脂质体经验:已成功开发多种抗疱疹、抗流感、抗HIV脂质体制剂;
✅ 自主脂质库:200+种脂质,含DMF备案药用辅料;
✅ 病毒模型平台:具备BSL-2级MPXV假病毒及合作活病毒评价能力;
✅ 全链条整合:从处方→冻干→药效→CMC无缝衔接;
✅ 数据合规:GLP规范,支持FDA/EMA/NMPA申报。
四、参考文献支持
参考文献:“Liposomal cidofovir: enhanced antiviral activity against orthopoxviruses and improved safety profile”
摘要节译:脂质体包裹的cidofovir(L-CDV)在体外对多种正痘病毒(包括猴痘病毒)表现出比游离药物高10–100倍的抗病毒活性,且在动物模型中显著降低肾毒性。脂质体递送不仅延长了药物半衰期,还促进其在肝脏和脾脏等病毒复制器官的富集,为系统性抗痘病毒治疗提供了更安全有效的策略。
五、订购流程与服务须知
交付周期:
基础处方 + 体外表征:30–60工作日;
含MPXV假病毒抑制或动物模型验证:90–180工作日。
样品规格:10 mg – 1 kg级冻干粉或液体,附COA;
包装运输:-20℃/-70℃冷链,铝箔袋/密封桶,全程温控记录;
验收标准:收货7日内按合同及COA验收,异议需书面反馈并留样;
保密承诺:签署NDA,所有数据与知识产权归客户所有。
应对新发痘病毒威胁,脂质体赋能下一代抗猴痘疗法!
选择中新康明,让您的抗MPXV脂质体药物从实验室快速走向应急使用或临床应用。我们不仅是CDMO,更是您值得信赖的抗病毒创新伙伴。
 返回
返回