随着SARS-CoV-2病毒持续变异及全球公共卫生需求的演变,基于mRNA技术的疫苗与治疗策略已成为应对新冠疫情的核心手段。其中,脂质纳米粒(Lipid Nanoparticle, LNP)作为mRNA的高效递送载体,其配方设计直接决定了抗原表达效率、免疫应答强度、制剂稳定性及临床安全性。中新康明提供脂质体、LNP纳米粒、水凝胶、微球等主流递送系统的全流程开发服务。依托自主脂质库、微流控平台与全链条开发能力,专注于SARS-CoV-2特异性mRNA-LNP脂质体配方的系统性研究,为客户提供从分子设计、工艺开发到生物学验证的全流程服务。
一、中新康明提供mRNA-LNP的全流程研发服务包括:
1.脂质组分的精准筛选与组合优化
基于编码SARS-CoV-2刺突蛋白(Spike)、受体结合域(RBD)或保守T细胞表位的修饰mRNA序列,我们构建四元脂质体系:
可电离阳离子脂质ALC-0315:优选高内体逃逸效率、低炎症反应的专利脂质,确保在酸性内体中质子化以促进膜融合;
辅助磷脂(Helper Lipid):采用DSPC,增强LNP双层结构稳定性;
胆固醇(Cholesterol):调节膜流动性,提升血清稳定性并延长循环时间;
PEG化脂质(PEG-Lipid):如DMG-PEG2000或可降解型PEG脂质,控制粒径均一性并减少MPS清除。
注:所有脂质均通过药用级认证,部分为中新康明自研新型脂质,具备更高包封率与更低肝毒性。
2.关键处方参数调控
针对新冠mRNA疫苗的免疫学特性,重点优化:
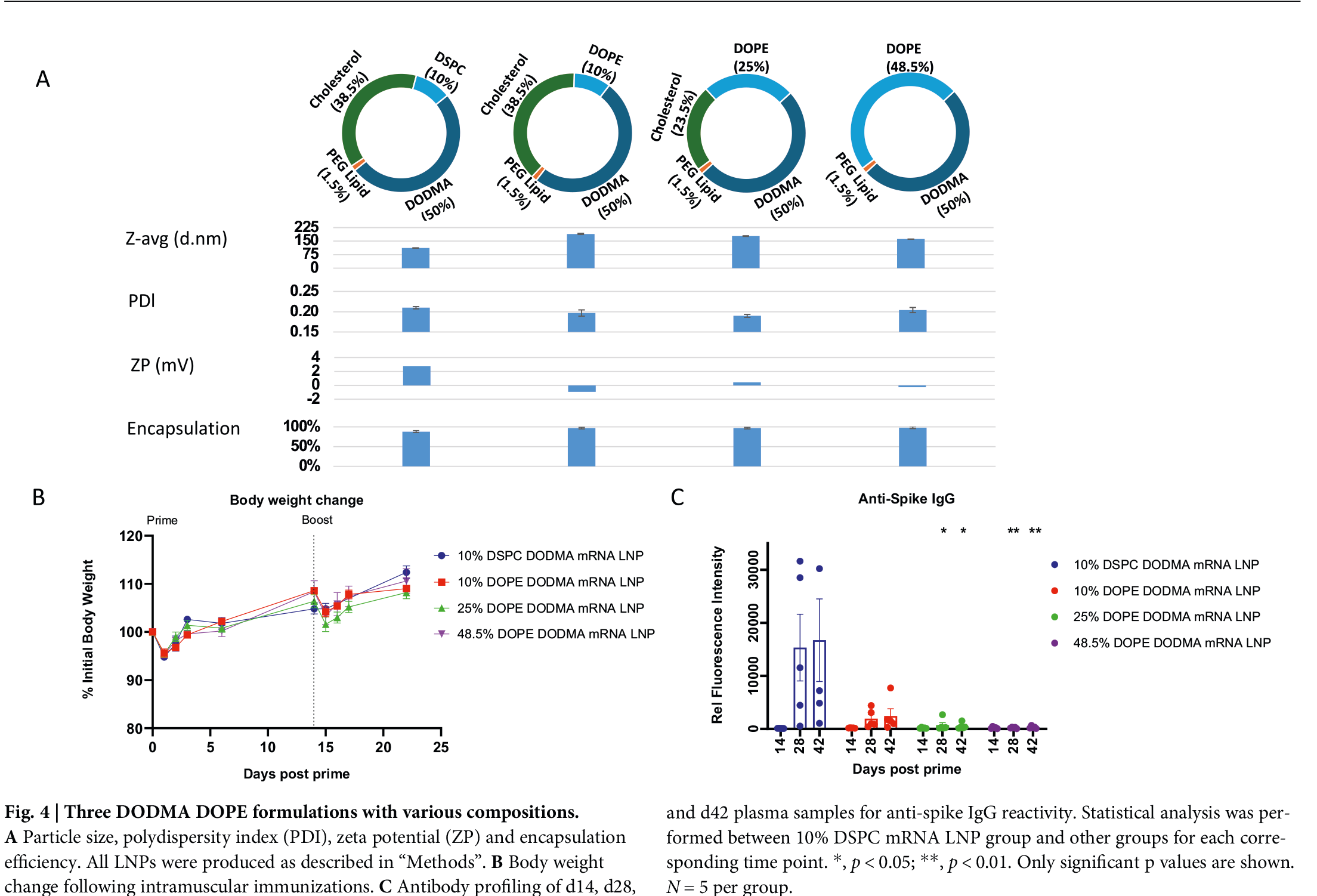
N/P比与脂质比例:通常阳离子脂质:DSPC:胆固醇:PEG脂质 = 50:10:38.5:1.5(mol%)为基础进行微调;
mRNA负载量:维持在10–20 μg/mg脂质,兼顾表达效率与制剂粘度;
粒径分布:目标80–110 nm(PDI < 0.15),利于淋巴结引流与树突状细胞摄取;
Zeta电位:接近中性(-3至+3 mV),减少非特异性蛋白吸附;
包封率:>95%,保障mRNA完整性与体内递送效率。
3.LNP制备与工艺开发
采用芯片式微流控混合技术实现高重现性LNP组装,通过精确调控水相(含mRNA)与乙醇相(含脂质)的流速比(FRR)、总流速(TFR)及混合温度,获得均一稳定的纳米颗粒。
小试阶段(1–10 mL):用于多组分配方初筛与体外转染评估;
中试放大(100 mL–1 L):完成工艺稳健性、批间一致性及冻干可行性研究;
GMP衔接:提供符合FDA/EMA/NMPA要求的CMC资料,支持IND申报所需的无菌灌装、稳定性方案及技术转移包。
4.全面理化表征与质量控制
对每一批SARS-CoV-2 mRNA-LNP进行严格质量属性分析:
粒径与PDI:动态光散射(DLS);
Zeta电位:激光多普勒电泳法;
mRNA包封率:RiboGreen荧光法 + 超滤分离;
mRNA完整性:毛细管电泳(CE)或Bioanalyzer检测;
热稳定性与储存稳定性:在-70℃、-20℃、4℃条件下考察3–12个月,监测粒径漂移、聚集、mRNA降解及活性损失;
内毒素与无菌检测:符合注射剂标准。
特别支持冻干工艺开发,已成功实现-20℃长期储存的稳定型mRNA-LNP制剂。
5. 体外与体内生物学功能验证
1. 体外验证
转染效率:在HEK293T、A549、DC2.4等细胞中检测Spike蛋白表达(流式细胞术、Western Blot、免疫荧光);
免疫激活能力:ELISA检测IL-6、TNF-α、IFN-β等细胞因子,评估佐剂效应与Th1偏向性;
细胞毒性:CCK-8/Annexin V检测,确认LNP生物安全性。
2. 体内验证(小鼠/仓鼠模型)
体液免疫应答:检测抗Spike IgG总抗体及中和抗体滴度(假病毒/活病毒中和试验);
细胞免疫应答:流式检测脾脏/淋巴结中CD4+/CD8+ T细胞活化及IFN-γ分泌;
组织分布:Cy5标记mRNA追踪LNP在肝、脾、淋巴结的富集;
攻毒保护实验(可选):在hACE2转基因小鼠或仓鼠模型中评估疫苗对SARS-CoV-2活病毒攻击的保护效力;
初步毒理:监测体重、ALT/AST、组织病理学(肝、脾、肺)。
6.定制化拓展:应对变异株与下一代疫苗需求
多价/嵌合mRNA-LNP:同时编码Delta、Omicron BA.5、XBB.1.5等变异株RBD,诱导广谱中和抗体;
自扩增mRNA(saRNA)适配:优化LNP配方以承载更大尺寸的复制子RNA,提升抗原表达持续时间;
黏膜免疫策略:开发鼻腔/吸入型LNP,通过表面修饰增强呼吸道滞留与局部IgA应答;
肝外靶向:通过PEG末端偶联靶向肽(如肺靶向、淋巴结靶向),提升免疫器官递送效率。
二、中新康明提供覆盖从设计到生产的完整LNP(脂质纳米粒)开发服务:
1.配方开发:基于药物类型与递送需求,定制化筛选脂质组分与比例,支持多种核酸类型(mRNA、siRNA等),并可进行表面功能修饰与稳定性优化。
2.生物学验证:提供体外细胞递送与安全性评估,以及小鼠体内表达、分布与初步毒理研究。
3.工艺开发与放大:建立微流控等制备工艺,完成参数优化与纯化冻干步骤,支持从毫升到百升级的稳定放大与全面表征。
4.非GMP/GMP生产:提供百升级至公斤级非GMP生产,以及符合临床Ⅰ–Ⅲ期要求的GMP无菌灌装与样品供应。
5.分析与法规支持:包括关键质量属性分析方法开发、稳定性研究及CMC与注册申报支持。
我们致力于为客户提供高效、合规且可定制的LNP全程解决方案。
三、中新康明的核心优势
✅ 自主脂质库:涵盖200+种可电离脂质,支持快速迭代与知识产权规避;
✅ 微流控平台标准化:批次间粒径RSD < 5%,包封率 > 95%;
✅ 全链条整合能力:从处方设计→工艺开发→GMP生产→CMC申报无缝衔接;
✅ 早期GMP意识:在Pre-IND阶段即引入QbD(质量源于设计)理念,确保数据合规;
✅ 灵活定制服务:支持肝外靶向、冻干、多价、saRNA等前沿需求。
四、参考文献和文献引用
参考文献:“Alkaline phosphatase-triggered charge converting lipid nanoparticles: An innovative approach for oral nucleic acid delivery”
节选翻译:酶响应型脂质纳米颗粒(LNPs)为胃肠道肿瘤的口服核酸递送提供了一种有前景的策略。我们假设用聚磷酸盐(PP)包被LNPs可增强黏液渗透性,并在肠碱性磷酸酶(IAP)激活时实现电荷转换。细胞穿透肽(CPP)硬脂酰-D-精氨酸8的存在可增强细胞摄取。对LNPs的大小、多分散性指数、Zeta电位、电荷转换进行了表征,并对其pH稳定性、在生物相关流体中的行为以及黏液扩散进行了评估。将编码绿色荧光蛋白(GFP)或脑酸性可溶性蛋白1(BASP1)的质粒DNA封装在其中,并在肠癌细胞系中研究了其摄取和转染情况。在与IAP孵育后,PP包被的D-精氨酸8-LNPs释放磷酸基团并发生电荷转换。这些颗粒在pH值1.5至9.0范围内保持稳定,并且对生物相关流体具有更强的抗性,尽管在消化酶的作用下会发生不稳定。与DOTAP和D-Arg8-LNPs相比,PP包被的LNPs在难以转染的Caco-2和SW480细胞中表现出更优的黏液扩散、细胞摄取和转染效率。重要的是,来自LNPs的BASP1表达有效抑制了SW480细胞的增殖。总体而言,用于口服给药的PP包被的LNPs能够有效地将核酸递送至肠道肿瘤细胞,这可能适合用于干扰肿瘤发生表型。
五、订购流程与服务须知
交付周期:基础配方筛选 + 体外表征:30–60工作日;含动物免疫原性验证项目:90–180工作日。
样品规格:提供0.1 mg至100 mg mRNA剂量的LNP制剂,支持冻干粉或液体形式。
包装与运输:全程-70℃或-20℃干冰冷链运输,附温控记录仪数据及COA质量报告。
验收标准:收货后7个工作日内依据合同技术指标及COA完成验收,异议需书面提出并留样复测。
保密承诺:严格签署NDA,所有实验数据、技术方案及知识产权归客户所有。
加速您的SARS-CoV-2 mRNA疫苗研发——选择中新康明,让科学更快抵达临床!
我们不仅是技术服务商,更是您值得信赖的核酸药物创新伙伴。
 返回
返回