随着肿瘤免疫治疗研究的不断深入,如何在激活抗肿瘤免疫反应的同时降低系统性毒副作用,成为当前肺癌治疗领域关注的核心问题。程序性死亡配体1(PD-L1)作为免疫检查点通路中的关键分子,其在肿瘤免疫逃逸中的作用已得到广泛证实。基于PD-L1的基因调控与免疫刺激因子协同递送,正逐渐成为肺癌治疗研究中的重要方向。
近期研究构建了一种以聚乙烯亚胺(PEI)为核心材料的脂质纳米颗粒(PEI-LNPs),同时负载PD-L1-siRNA与编码免疫刺激性白细胞介素2(IL-2)的质粒DNA,在体外肺癌模型中展现出显著的免疫调节与抗肿瘤潜力。该研究为PEI-LNPs在肺癌免疫基因治疗中的应用提供了系统性验证,也为相关纳米药物的开发与转化奠定了坚实基础。

一、PEI-LNPs在肺癌治疗中的开发前景与研究新方向
传统肺癌治疗多集中于化疗、靶向药物或免疫检查点抗体,但单一治疗策略往往面临疗效有限、耐药性或免疫相关不良反应等挑战。基于核酸药物的纳米递送体系,为肺癌治疗提供了更具精准性和可调控性的解决方案。
PEI作为经典的非病毒基因递送材料,具有较高的核酸结合能力和“质子海绵效应”,有助于siRNA和pDNA在细胞内逃逸溶酶体降解。通过与脂质材料协同构建PEI-LNPs,可在降低PEI毒性的同时显著提升转染效率和生物相容性。
在上述研究中,PEI-LNPs实现了PD-L1-siRNA与IL-2pDNA的协同递送,一方面通过下调肿瘤细胞PD-L1表达解除免疫抑制,另一方面在肿瘤局部诱导IL-2表达以增强T细胞活化。这种“免疫检查点阻断+免疫刺激因子表达”的双重机制,代表了肺癌免疫基因治疗的重要发展方向。
未来,围绕PEI-LNPs的研究将进一步聚焦于靶向修饰、载荷比例精细调控、肿瘤微环境响应释放以及体内安全性与药效评价,为其向临床前乃至临床应用推进创造条件。

二、中新康明提供的非GMP级PEI-LNPs原料与CDMO支持服务
一、PEI-LNPs核心原料供应服务(非GMP级)
1.聚乙烯亚胺(PEI)及其改性材料
不同分子量PEI(如800/1.8k/2k/10k/25k等)
线性PEI/支链PEI
疏水化改性PEI(如脂肪酸修饰PEI)
功能化PEI(可用于降低毒性、提升稳定性或转染效率)
PEI结构表征与批间一致性支持
2.脂质与辅助材料
中性脂质(如DOPC、DSPC等)
胆固醇及其衍生物
表面稳定剂与辅助成膜材料
可用于构建PEI-脂质复合纳米体系的实验级辅料
3.核酸相关原料支持(研发级)
siRNA递送体系适配支持(PD-L1-siRNA等)
质粒DNA(pDNA)递送体系适配支持(如IL-2编码质粒)
siRNA/pDNA与载体匹配性评估建议
多核酸共载体系原料兼容性设计支持
二、PEI-LNPs制剂开发与处方优化服务
1.PEI-LNPs制备工艺支持
PEI-脂质复合纳米颗粒制备方案设计
多种实验室级制备工艺支持(如乳化-溶剂挥发、超声法等)
关键工艺参数优化(投料比、溶剂体系、能量输入条件等)
2.核酸负载与共载体系构建
PEI-LNPs与siRNA的静电复合策略
PEI-LNPs与pDNA的装载条件优化
siRNA+pDNA共载体系构建
不同质量比/摩尔比条件下的装载能力评估
3.处方筛选与稳定性初评
不同PEI分子量与脂质配比筛选
粒径、电位与稳定性综合优化
短期储存稳定性与体系重现性评估
三、PEI-LNPs物理化学与结构表征服务
1.基础理化性质检测
粒径及粒径分布(DLS)
Zeta电位测试
PDI(多分散指数)评估
不同条件下体系稳定性分析
2.形貌与结构表征
透射电子显微镜(TEM)
纳米颗粒形态与结构完整性评估
PEI包覆与核酸吸附状态分析
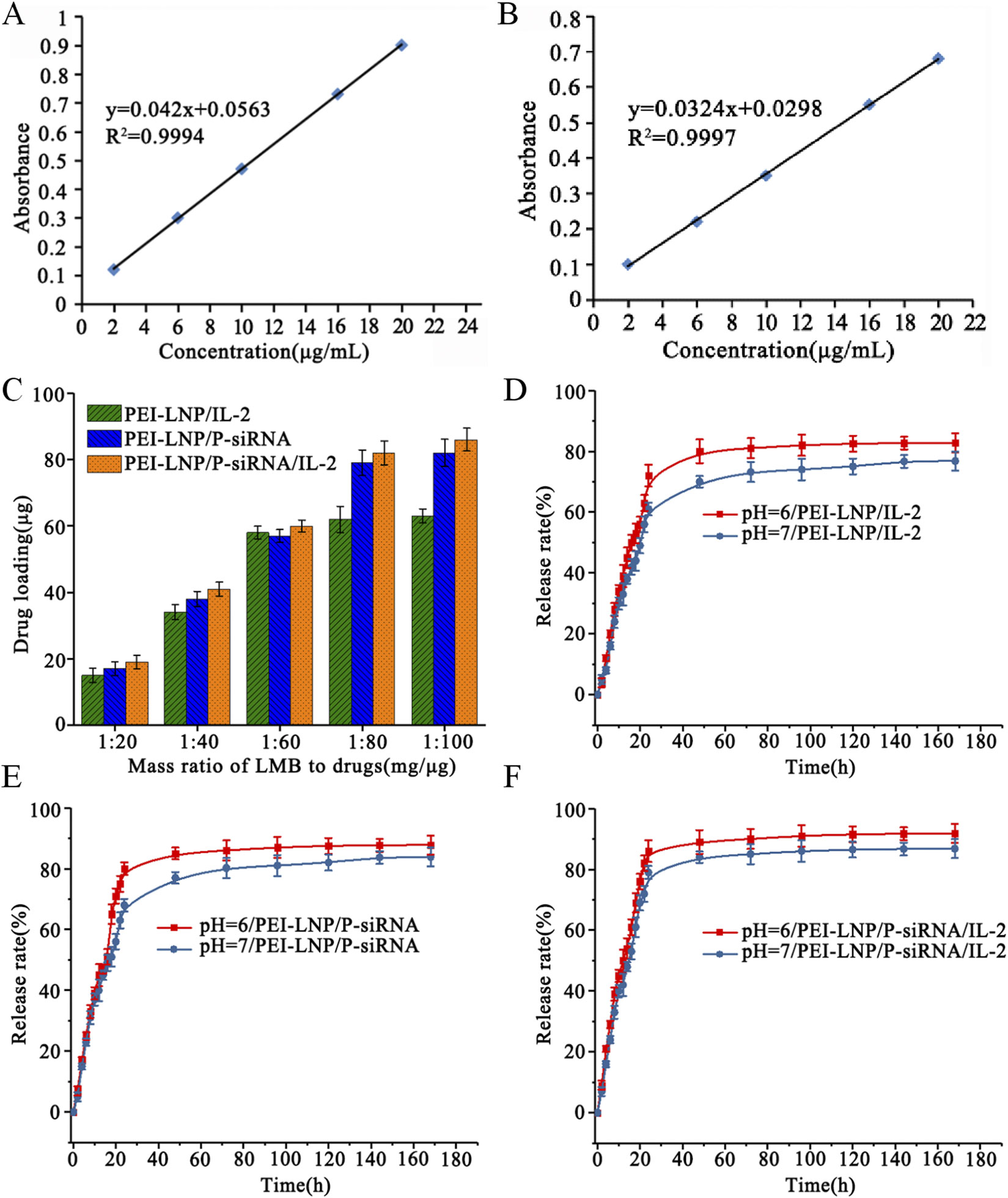
3.载药与释放性能研究
siRNA/pDNA装载量与装载效率测定
不同pH条件下释放行为研究
模拟肿瘤微环境的释放特性评估
三、中新康明在PEI-LNPs药物CDMO服务中的技术优势
针对PEI-LNPs这一兼具高转染效率与安全性挑战的纳米体系,中新康明在技术层面形成了多项优势。
首先,中新康明在聚合物-脂质复合纳米体系的设计与构建方面积累了丰富经验,能够根据核酸类型与应用场景灵活调整PEI分子量、修饰方式及脂质配比,从源头上平衡转染效率与细胞相容性。
其次,在核酸装载与释放行为研究方面,中新康明可通过系统化实验设计,协助客户明确不同质量比、pH条件及环境因素对siRNA/pDNA释放动力学的影响,为后续机制研究和体内应用提供依据。
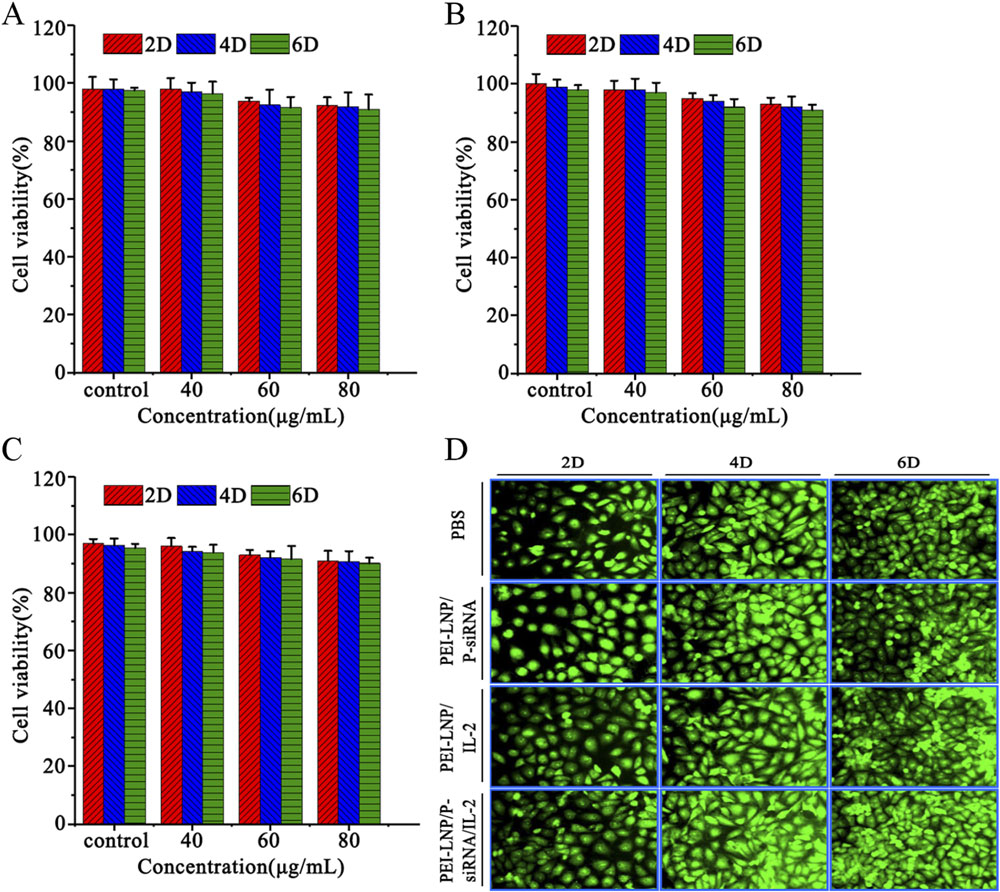
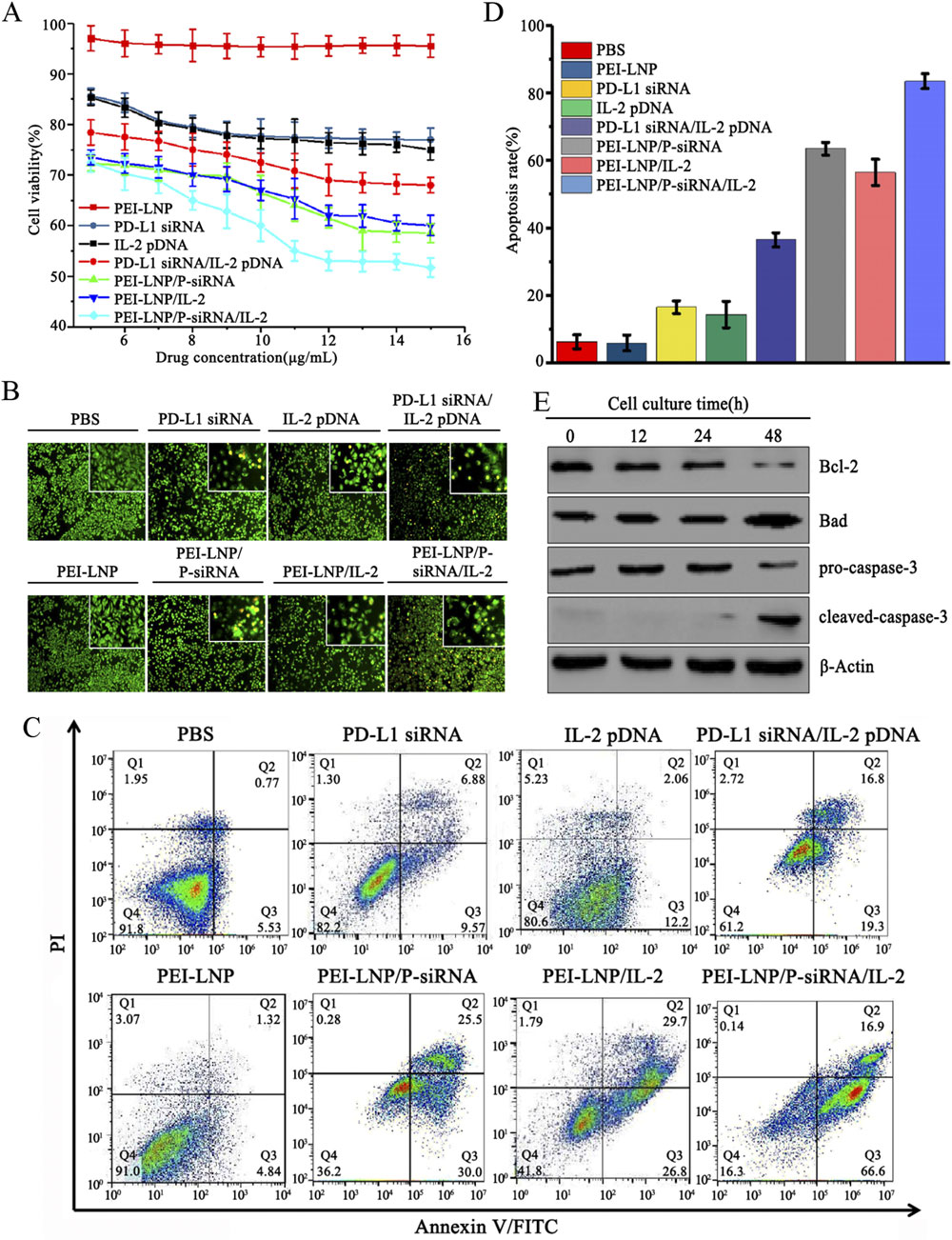
此外,中新康明具备完善的体外评价能力,可支持细胞毒性、细胞摄取、基因沉默效率、细胞因子表达及免疫共培养模型等实验,帮助客户从功能层面验证PEI-LNPs的治疗潜力。
参考文献:“Construction of PD-L1-siRNA and IL-2 DNA loading PEI lipid nanoparticles in activating T cells and treating lung cancer”
文献节选:人类程序性死亡配体1(PD-L1)的信号转导作为免疫系统中的一个重要检查点基因,在癌细胞的内部功能和存活中发挥着关键作用。本文构建了聚乙烯亚胺(PEI)脂质纳米颗粒(PEI-LNPs)负载的PD-L1-siRNA和编码免疫刺激性白细胞介素2(IL-2)的质粒DNA。对其治疗肺癌的效果进行了评估,并测量了其物理参数,如粒径和电位。通过体外实验测试了PD-L1-siRNA/IL-2DNA-PEI-LNPs的结合能力、细胞毒性、细胞凋亡和细胞摄取能力。还检测了A549癌细胞中PD-L1的下调效果以及共培养T细胞的细胞因子水平。研究表明,PD-L1-siRNA/IL-2-PEI-LNP复合物能够为肺癌细胞提供有效的治疗;IFN-γ和TNF-α水平的显著升高以及IL-10水平的降低证实了分泌细胞因子的变化。本研究构建的脂质纳米颗粒与肿瘤靶向治疗基因siRNA/pDNA相结合,在体外具有靶向细胞的能力,并能下调PD-L1的表达,实现了免疫刺激细胞因子的肿瘤特异性表达,被认为是一种高效且安全的靶向治疗纳米载体。
四、相关研发案例介绍
在多个肿瘤及免疫相关项目中,中新康明已协助客户开展PEI-LNPs及类似核酸纳米制剂的早期开发工作。例如,在肺癌免疫调控研究中,中新康明支持客户完成PEI-LNPs的配方筛选与物理化学表征,并结合PD-L1相关siRNA开展体外功能验证,获得稳定可重复的数据结果。在其他免疫因子或联合基因递送项目中,中新康明同样通过定制化方案,协助客户实现多核酸共载体系的构建与优化,为后续深入研究提供坚实基础。
五、中新康明CDMO综合服务能力综述
作为专注于先进材料与纳米药物研发支持的技术平台,中新康明致力于为客户提供贯穿科研探索阶段的综合CDMO服务。从前期材料选择、制剂设计,到多维度数据检测与技术咨询,中新康明始终以“赋能研发、加速转化”为核心目标。
在PEI-LNPs等非GMP级纳米药物开发领域,中新康明不仅关注单一实验结果,更重视体系稳定性、可扩展性与未来转化潜力的系统评估。通过专业化、模块化的服务模式,中新康明助力客户在复杂的核酸纳米药物研发过程中降低试错成本、提升研发效率。
面向未来,中新康明将持续深化在免疫基因治疗、纳米递送体系及多组分复合制剂领域的技术积累,与合作伙伴共同推动肺癌及其他重大疾病治疗策略的创新发展。
 返回
返回