随着核酸药物在炎症性疾病、代谢病及肿瘤治疗领域的持续突破,如何高效、精准、安全地将siRNA或反义寡核苷酸递送至特定细胞类型成为未来治疗策略的重要方向。在这一过程中,脂质纳米颗粒(LNP)已经成为最成熟、最具临床前景的核酸递送载体体系。其中,阳离子脂质的选择与配比是影响递送效率、细胞摄取、内体逃逸和生物分布的核心因素。
近期研究表明:永久性阳离子脂质(如DOTAP)具有提升细胞摄取的能力,而可离子化阳离子脂质(如MC3)则在促进内体释放方面更具优势。因此,将两类脂质进行功能互补式组合,有望显著提高内皮细胞中的转染效率和基因沉默水平。
基于此科学进展,中新康明围绕DOTAP/MC3复合体系构建了全新的LNP配方开发策略,成功建立了一套适用于siRNA内皮细胞靶向递送的新型工艺平台,并同步推出涵盖 脂质原料研发—公斤级供应—处方筛选—工艺开发—质量检测—中试放大—法规注册支持的端到端CDMO服务体系。
一、新型DOTAP复合脂质体系的科学背景与技术价值
研究显示,单独使用DOTAP或MC3进行siRNA递送时,效果具有一定局限性:
DOTAP-LNP:细胞摄取率高,但内体逃逸有限,可能限制基因沉默效率;
MC3-LNP:在酸性内体环境下有效质子化,能促进siRNA释放,但对特定类型内皮细胞的摄取效率仍不足。
因此,通过调控DOTAP:MC3的摩尔比,构建混合阳离子脂质体系,可在摄取能力与内体释放能力之间实现新的平衡。研究团队以 永久性阳离子 + 可离子化阳离子脂质组合 为策略,成功制备出多种复合LNP体系,并验证了其在内皮细胞中显著增强siRNA基因沉默的能力。
关键发现包括:
混合DOTAP/MC3的LNP在摄取效率与内体逃逸之间实现最佳平衡;
特定摩尔比的DOTAP/MC3-LNP在内皮细胞中可显著增强siRNA释放;
在斑马鱼GFP-内皮转基因模型中,新型LNP显示更佳组织分布与体内基因沉默能力;
新型制剂有望成为 慢性炎症性疾病 的新型治疗策略。
中新康明以此为基础,正式推出面向DOTAP/MC3新型工艺的专业化 CDMO服务体系。
二、中新康明在DOTAP脂质研发与制备中的技术优势
作为国内领先的核酸递送脂质原料与LNP技术平台企业,中新康明已经建立成熟的DOTAP、DODAP、DODMA、MC3等可离子化脂质的公斤级生产体系,包括:
多路线合成开发(适配GMP/非GMP需求)
高纯度原料生产(≥98–99%)
杂质谱解析与去除策略
稳定性研究与储存体系验证
大包装/公斤级/百公斤级交付能力
所有DOTAP原料可提供以下全套检测报告:
NMR、MS、HPLC、GC
残留溶剂/残留催化剂
酸值/过氧化值
氧化降解物监测
微生物限度/无菌检测(如需要)
这些能力为后续LNP配方优化提供了坚实的原料基础。
三、中新康明对DOTAP新型配方工艺的深入研究
在DOTAP/MC3复合阳离子体系基础上,中新康明构建了完整的配方开发平台,在以下方面具有突出优势:
1. 阳离子脂质比例优化(DOTAP:MC3)
通过高通量处方筛选技术,中新康明能够快速评估不同摩尔比分布下:
细胞摄取效率
内体逃逸效率
siRNA的释放速率
细胞内分布模式
脂质体的结构稳定性
可实现对DOTAP/MC3在0–100%任意比例间的系统评估。
2. 微流控/乙醇注入工艺开发
结合不同核酸结构(siRNA/ASO/mRNA)的理化特征,中新康明能够灵活调整:
buffer pH(促进阳离子脂质电荷调控)
流速/流量比(FRR)
内外水相组成
PEG-lipid含量
乙醇比例与溶剂去除方式
以获得最优粒径(60–120 nm)、PDI (<0.15)、高封装效率(>90%)的 LNP。
3. 内皮定向特性研究支持
基于企业自身的表征平台,可对DOTAP/MC3-LNP的内皮细胞表现进行系统性评估,包括:
内皮细胞特异摄取
siRNA释放速率
基因沉默效率
炎症指标下调分析
索式斑马鱼与小鼠体内分布
为客户提供可直接用于申报的技术数据包。
四、LNP质量检测与分析表征能力
中新康明拥有完整的LNP分析体系,可提供:
粒径/分布/电位(DLS)
封装效率/载药量分析
Cryo-TEM微观结构
HPLC/GPC脂质比例测定
体外转染与基因沉默测试
血清稳定性/体外降解
内体逃逸机制表征
动物体内暴露与组织分布
为所有LNP产品提供全程质量追溯。
五、从实验室到商业化的 CDMO全链路服务
中新康明围绕DOTAP/MC3新型LNP制剂建立了成熟的核酸药物CDMO体系,包括:
1. 原料:可离子化脂质公斤级供应
DOTAP、MC3、DODMA、DODAP等脂质均可实现公斤级以上批量交付。
2. 配方与工艺开发
LNP处方筛选
DOTAP/MC3摩尔比优化
适配不同siRNA的工艺探索
微流控/乙醇注入工艺开发
3. 中试放大与GMP工艺设计
100 mL→1 L→10 L→100 L梯度放大
工艺验证文件(PPQ)
稳定性研究与批间一致性验证
4. 申报与法规支持
CMC材料撰写
DMF/原料注册证申请
IND申报技术支持
质量体系审计配合
客户可直接依托中新康明实现从概念研究→临床前→IND→工业化生产的快速推进。
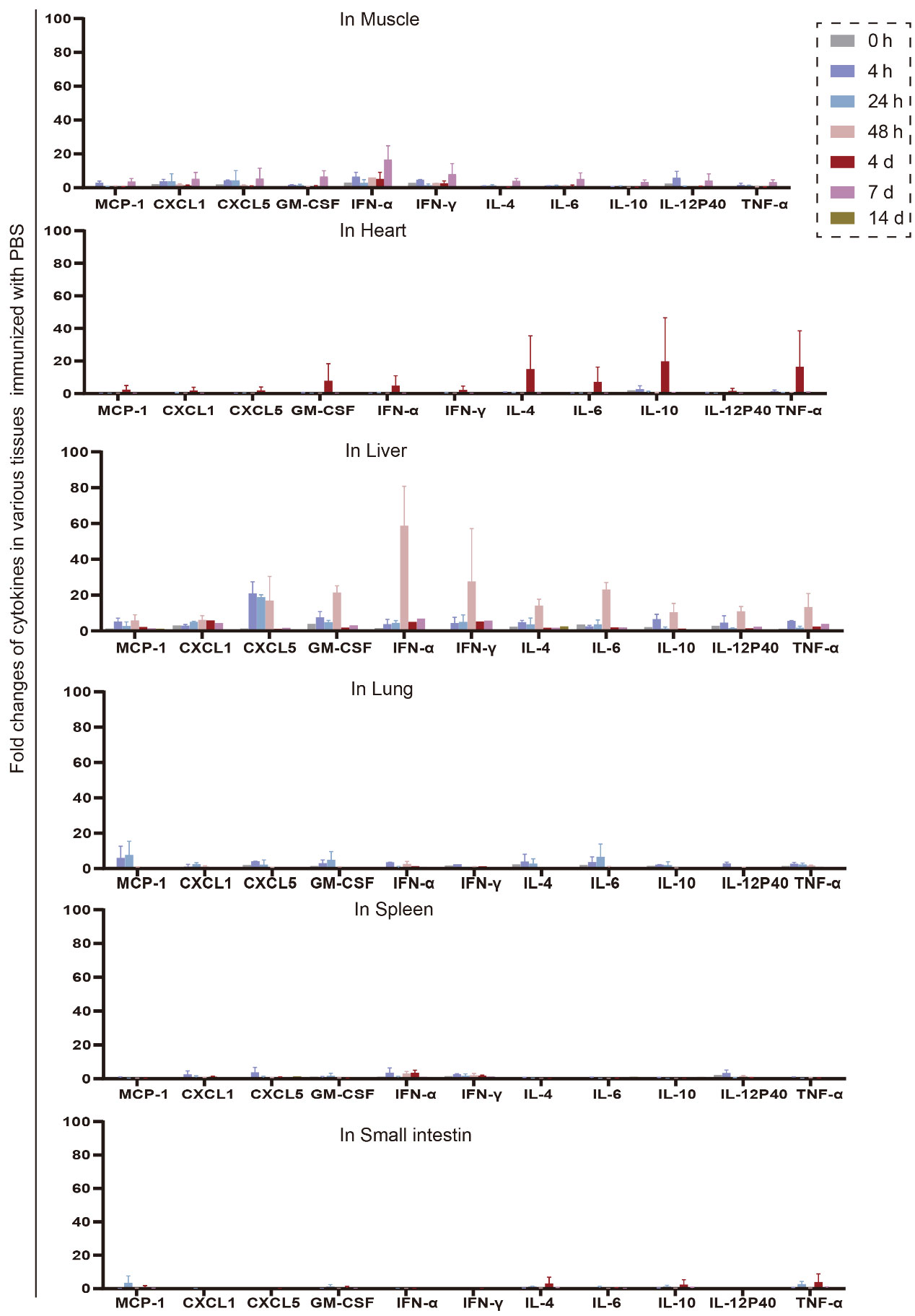
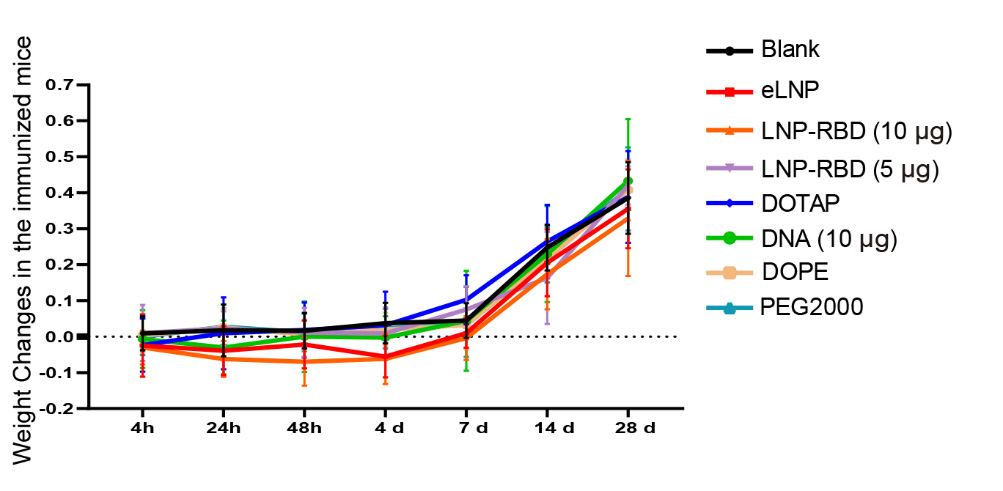
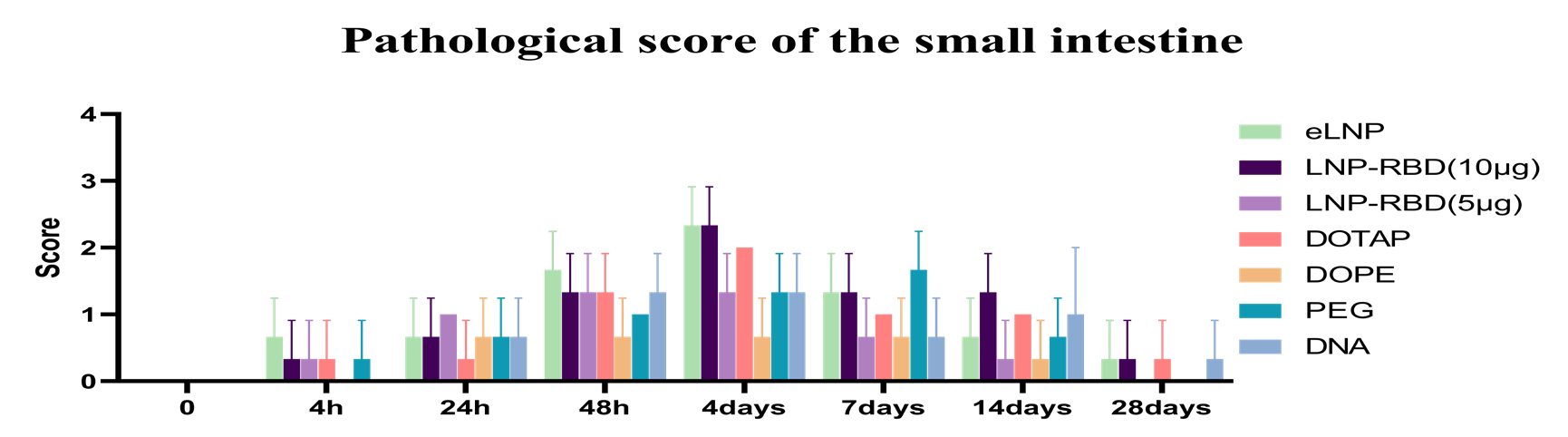
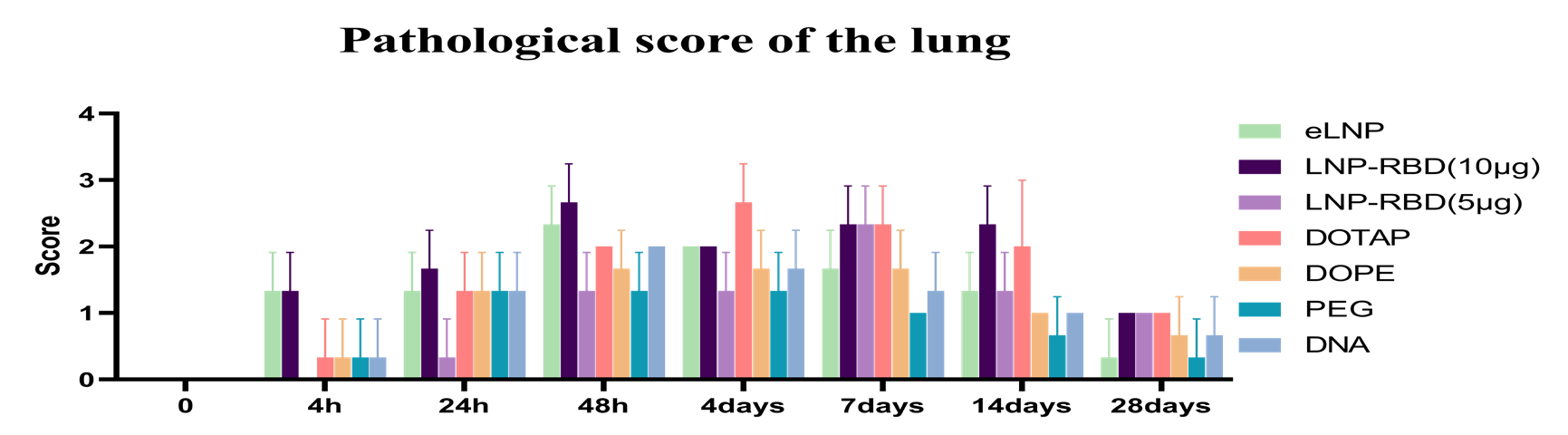
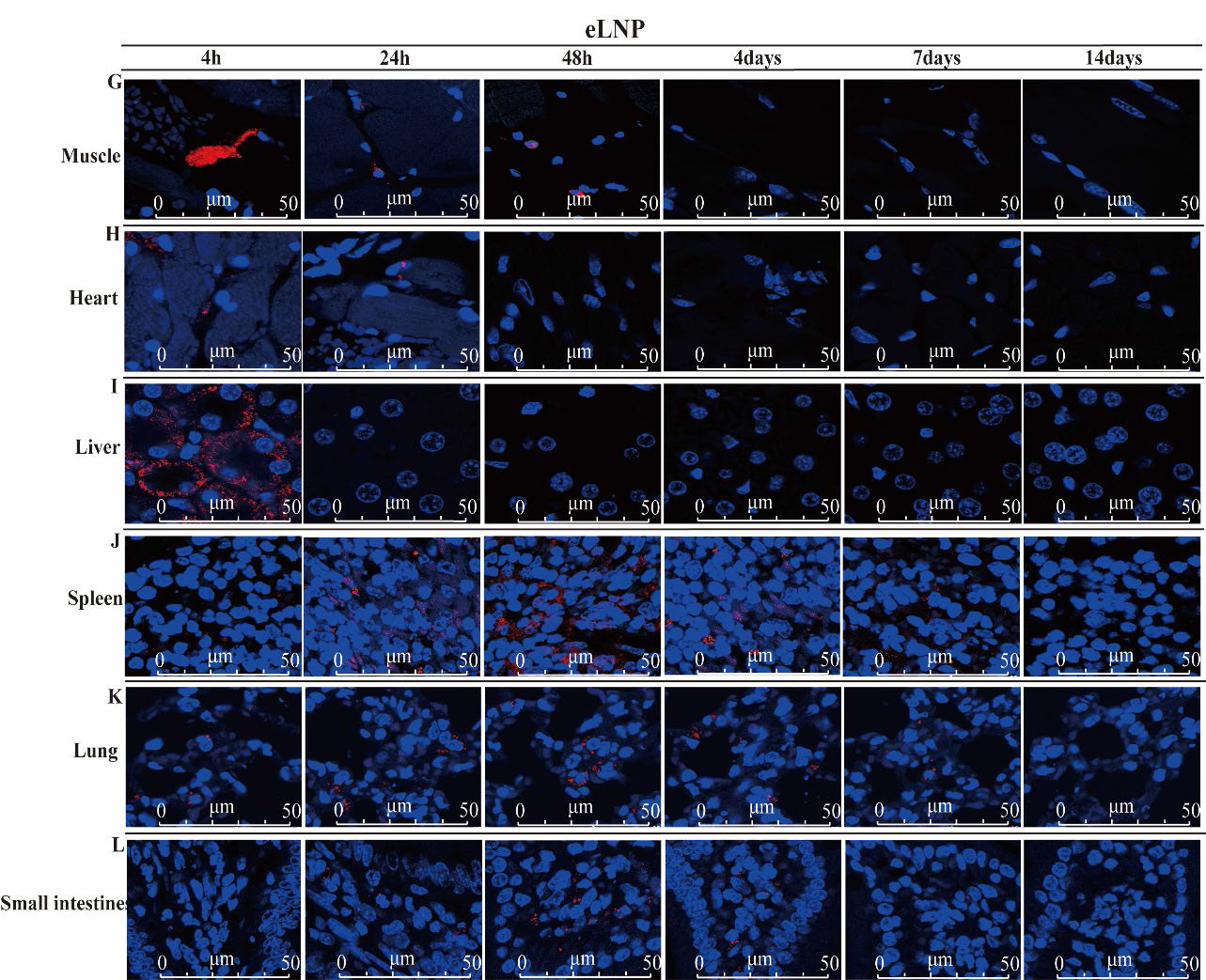
文献引用“Pathologic tissue injury and inflammation in mice immunized with plasmid DNA encapsulated DOTAP-based LNPs”
文献节选:由于永久性阳离子脂质能提高细胞摄取,而可离子化的阳离子脂质能改善细胞内的处理过程,因此我们推测,将永久性阳离子脂质和可离子化的阳离子脂质结合用于 siRNA 的传递,可能会在内皮细胞中实现更强的基因沉默效果。我们通过改变阳离子脂质的组成,制备了三种 LNP:(1)含有永久性阳离子脂质(DOTAP)的 LNP;(2)含有可离子化阳离子脂质(MC3)的 LNP;以及(3)含有不同摩尔比的 DOTAP 和 MC3 的 LNP。我们研究了不同 LNP 制剂的体外转染效率以及与原代内皮细胞中高转染效率可能相关的机制。我们还在绿色荧光蛋白(GFP)-内皮细胞转基因斑马鱼模型中研究了生物分布、siRNA 在细胞内的释放以及体内基因沉默情况。通过比较研究阳离子脂质的辅料以及优化基于阳离子脂质的 LNP 制剂,我们开发了一种用于增强(激活)内皮细胞中基因沉默的新型 LNP/siRNA 制剂。这种制剂有望用于治疗慢性炎症性疾病,通过减轻内皮细胞的激活来发挥作用。
六、总结
通过结合永久性阳离子脂质DOTAP与可离子化阳离子脂质MC3的优势,新型LNP配方在内皮细胞中展现出显著增强的siRNA基因沉默能力,并具有向慢性炎症疾病治疗转化的潜力。
中新康明在DOTAP原料生产、处方优化、工艺开发、质量检测、中试放大与法规申报方面构建的系统化能力,使其成为国内能够提供 从脂质原料到LNP完整开发链条的领先CDMO企业。未来,中新康明将持续投入可离子化脂质与新型核酸递送体系的研究,加速核酸治疗技术的产业化落地。
 返回
返回