登革热(Denguefever)由DENV-1、DENV-2、DENV-3和DENV-4四个血清型病毒引起,是全球传播最广泛的虫媒病毒病之一。由于存在抗体依赖增强效应(ADE),开发能够同时覆盖四个血清型的四价疫苗成为关键。
mRNA疫苗平台具备快速设计、免疫原性强、多价灵活组合等优势,而脂质纳米颗粒(LNPs)递送系统则是其成功的基础。特别是SM-102,作为新冠疫苗中已验证的可电离脂质,展现出良好的安全性与递送效率,成为登革四价mRNA疫苗构建的优选材料。
一、SM-102在登革四价mRNA疫苗递送中的优势
高效递送与均衡表达
SM-102在酸性环境下质子化,能高效包载mRNA分子;在生理条件下趋于中性,降低非特异性蛋白结合。
对四个血清型mRNA能实现均衡递送,避免因单一抗原表达过强而导致免疫失衡。
良好的组织分布与免疫激活
SM-102LNP注射后快速分布至淋巴结,促进树突状细胞摄取并触发高效抗原呈递。
在肌肉和淋巴组织保持时间较长,有利于持续免疫刺激,从而提升四价疫苗的保护广度。
可预测代谢与低毒性
通过酯酶降解为脂肪酸和中性产物,代谢途径明确,安全性可控。
减少在肝脏和脾脏的蓄积,降低长期毒性风险,符合FDA对可降解离子脂质的安全要求。
处方优化灵活性
通过调节SM-102与其他脂质(DSPC、胆固醇、PEG-lipid)的比例,可精确控制粒径、表面电荷及释放速率。
为多价mRNA疫苗提供更大的处方可塑性,保证不同血清型抗原的表达平衡。
二、SM-102在登革四价mRNA候选疫苗构建流程
1.抗原设计与mRNA合成
抗原选择:
以四个血清型DENV的E蛋白(Envelope)和prM蛋白为核心免疫原;
可融合NS1非结构蛋白片段以增强细胞免疫。
mRNA优化:
使用优化的5′/3′UTR,提升稳定性和翻译效率;
核苷修饰(如N1-methyl-pseudouridine)降低先天免疫干扰;
Cap结构和Poly(A)尾巴长度调整,提高翻译水平。
2.SM-102LNP配方构建
关键组分:SM-102(可电离脂质)+DSPC(结构脂质)+胆固醇+PEG-脂质;
处方优化目标:
粒径:80–100nm,利于淋巴结摄取;
包封率:>90%;
电位:中性偏弱负,降低毒性;
四条mRNA的摩尔比例均衡,避免免疫应答失衡。
3.体外与体内评价
体外实验:检测mRNA翻译效率、抗原蛋白表达水平;
小动物实验:评估四价抗原免疫原性,监测ADE风险;
非人灵长类模型:验证长期保护性与免疫均衡性。
4.工艺放大与制剂稳定性研究
中试放大:采用微流控混合技术实现批量制备;
稳定性优化:通过冻干或超低温储存维持LNP结构完整性;
质量控制:粒径分布、包封率、mRNA完整性与纯度检测。
三、中新康明基于SM-102的服务能力
作为专业的核酸药物递送与工艺开发平台,中新康明可在登革四价mRNA候选疫苗研发中提供以下服务:
1.LNP处方开发与优化
基于SM-102的LNP配方筛选与高通量优化
平衡四价mRNA的包封率与释放效率
提供DoE(实验设计)驱动的处方优化方案
2.体外与体内递送评价
mRNA表达水平与抗原蛋白检测
小动物免疫原性评价与ADE风险监测
组织分布与药代动力学分析
3.工艺放大与质量控制
微流控LNP制备工艺开发与中试放大
GLP/GMP标准下的粒径、包封率、纯度及稳定性检测
支持冻干保护剂筛选与长期稳定性研究
4.临床前与注册支持
提供符合监管标准的PK/PD与安全性研究服务
PBPK建模预测临床转化效果
IND申报所需的CMC与临床前研究资料支持
四、总结
SM-102在登革四价mRNA候选疫苗构建中,凭借其高效递送、均衡药代动力学与良好安全性,为突破登革热疫苗研发难题提供了新方案。
中新康明依托完善的递送技术平台、GMP工艺体系与临床前评价能力,可为合作伙伴提供从分子设计到临床申报的一站式服务,推动登革四价mRNA疫苗快速走向临床与市场。
五、参考文献
“登革四价mRNA候选疫苗的构建及其免疫效果研究”
关键词:登革病毒;小鼠模型;mRNA疫苗;ED-Ⅲ基因;免疫保护;
基金资助:国家重点研发计划项目(编号:2021YFC2301704);
专辑:医药卫生科技
专题:基础医学
DOI:10.27162/d.cnki.gjlin.2024.008117
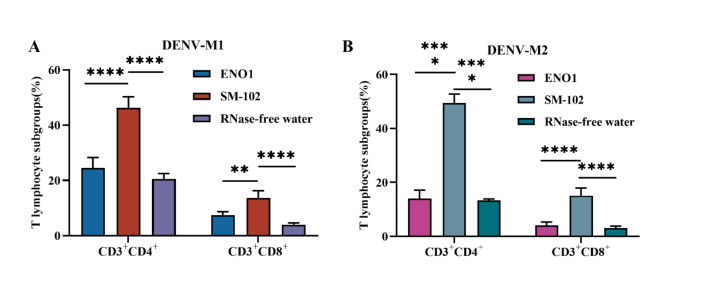
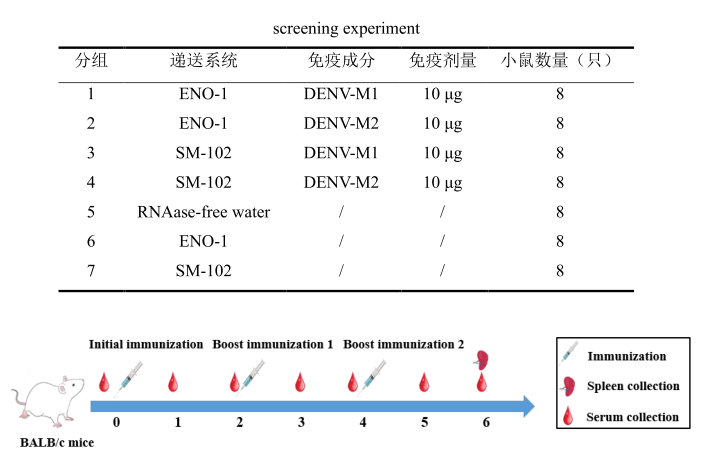
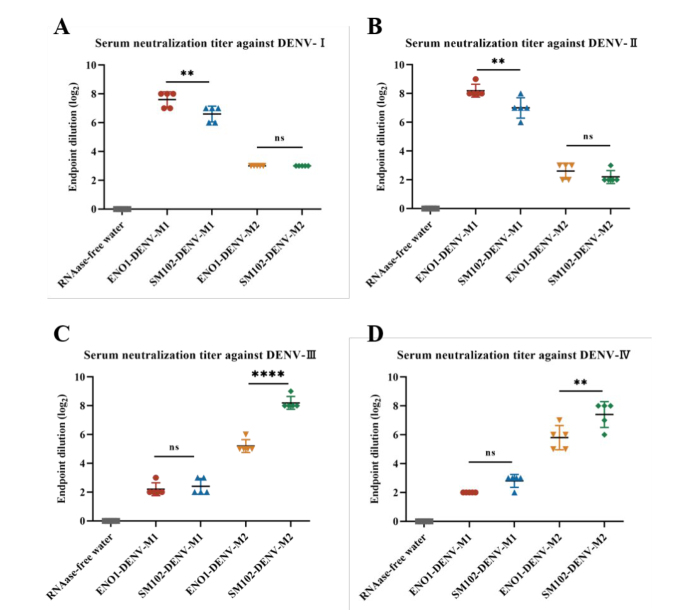
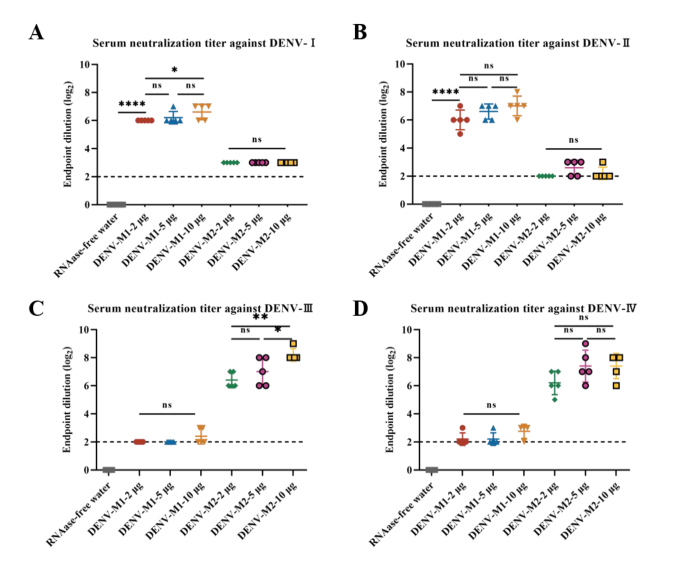
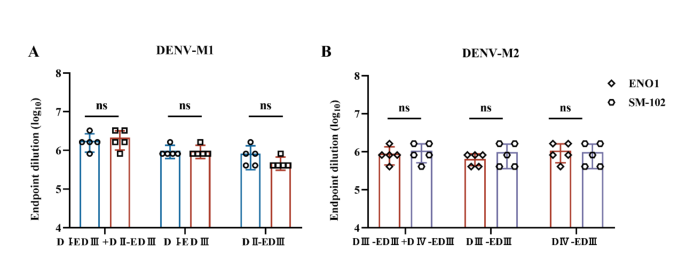
节选:利用SM-102(ModernaLNP制剂)和ENO1两种LNP进行包裹,其理化性质和包封率在标准范围内。通过体内感染确定其表达效率和生物学分布。体内实验结果表明,通过肌肉注射的方式,两种LNPs均能成功将目的蛋白递送到肌肉组织中,体内荧光持续时间均可达到72h,可在动物脾脏和肝脏中检测到荧光表达。综上,本研究制备的四种mRNA候选疫苗,分别命名为SM-102-DENV-M1、SM-102-DENV-M2、ENO1-DENV-M1和ENO1-DENV-M2可应用于后续免疫实验研究。3.登革病毒mRNA疫苗递送系统及免疫剂量筛选mRNA极易受到核酸酶的降解,因此递送载体是提高疫苗免疫原性的关键。本章节中选择了第二章中构建和鉴定的SM-102-DENV-M1、SM-102-DENV-M2、ENO1-DENV-M1和ENO1-DENV-M2分别免疫BALB/c小鼠,通过体液及细胞免疫反应评估两种递送系统和免疫剂量对疫苗免疫原性的影响。研究结果表明,使用两种递送系统免疫后均可诱导BALB/c小鼠产生较高的特异性IgG抗体和中和抗体,T淋巴细胞亚群检测结果显示ENO1组产生CD3+CD4+,CD3+CD8+阳性细胞的数量显著低于SM-102组。随后使用相同的免疫程序,将SM-102作为递送系统进行最佳免疫剂量的摸索,评估了2μg、5μg和10μg免疫剂量在BALB/c小鼠体内诱导的体液和细胞免疫水平,结果显示,接种5μg和10μg剂量SM-102-DENV-M1和SM-102-DENV-M2的小鼠在免疫后42天产生的特异性抗体和中和抗体无明显差异,2μg剂量诱导的抗体滴度最低,T淋巴细胞亚群结果显示出与特异性抗体和中和抗体相同的趋势。最终确定5μg为登革病毒mRNA候选疫苗的最佳免疫剂量。4.登革病毒mRNA候选疫苗免疫AGB6小鼠及攻毒保护评价为评估SM-102-DENV-M1和SM-102-DENV-M2免疫保护效果,分别选择5μg的免疫剂量,将两种疫苗混合并命名为SM-102-DENV-M1/M2,免疫AGB6小鼠,共进行3次免疫,每次间隔14天,在首次免疫后第42天进行攻毒。
 返回
返回