在甲状腺肿瘤谱系中,甲状腺髓样癌(MTC)因其高度恶性、早期即出现淋巴或远处转移、缺乏有效放射性碘治疗手段等特点,被公认为治疗难度高、临床进展空间有限的实体瘤类型之一。尽管多激酶抑制剂等靶向治疗在部分患者中显示获益,但疗效和毒性之间的平衡仍面临巨大挑战。
随着纳米医学、声动力治疗和多模态成像技术的不断发展,精准治疗MTC的新方向正在逐步形成。近期研究提出利用癌细胞膜仿生涂层、双模态超声/光声成像、可控声触发相变材料等构建的新型脂质纳米粒体系,为MTC提供了可视化、精准递送、低毒高效的潜在治疗方案。在这一技术趋势下,新一代脂质纳米系统,LNPs)再次成为肿瘤诊疗领域的焦点。
作为国内领先的纳米药物递送材料与制剂CDMO服务供应商,中新康明正持续拓展LNP原料、工艺开发与仿生纳米系统制备能力,为MTC等高难度肿瘤递送系统的创新研发提供专业化支持。
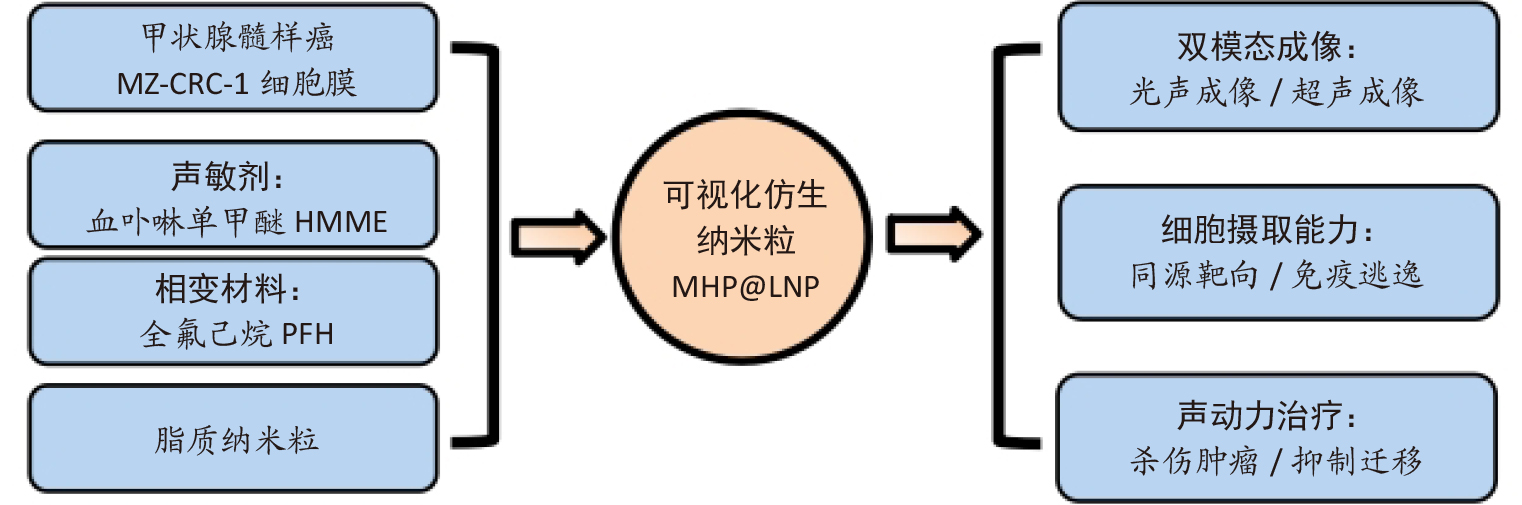
仿生脂质纳米粒MHP@LNP:双模态成像与声动力治疗的突破
中新康明采用二棕榈酰磷脂酰胆碱、二棕榈酰磷脂酰甘油、DSPE-PEG2000、胆固醇、血卟啉单甲醚HMME)及全氟己烷PFH)构建脂质纳米粒,并通过癌细胞膜包覆构建仿生体系。关键成果包括:
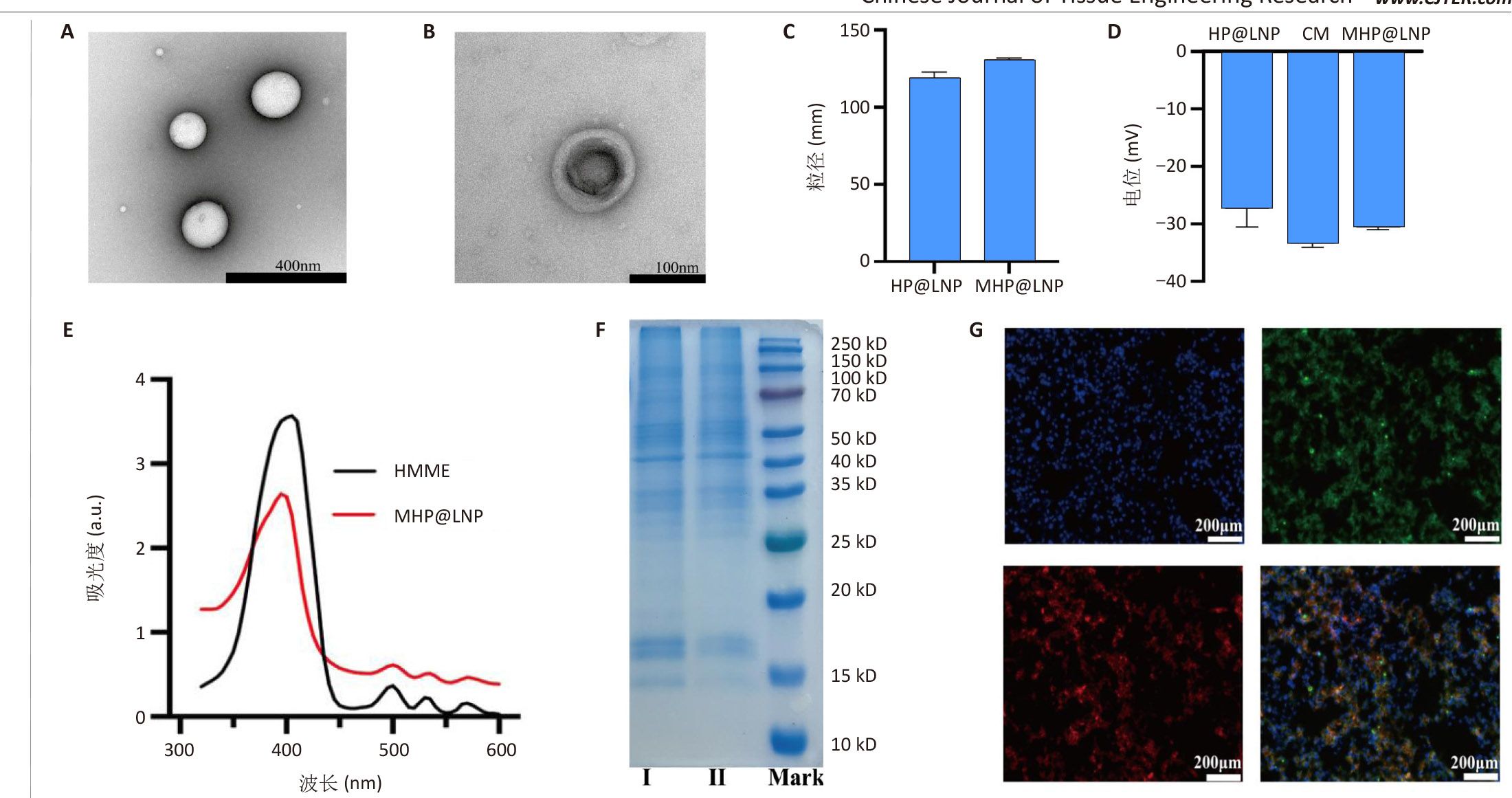
典型核壳结构:粒径131.06nm,Zeta电位-30.59mV,成功呈现癌细胞膜的完整蛋白谱。
高效载药效率:HMME包封率87.8%,载药率14.6%。
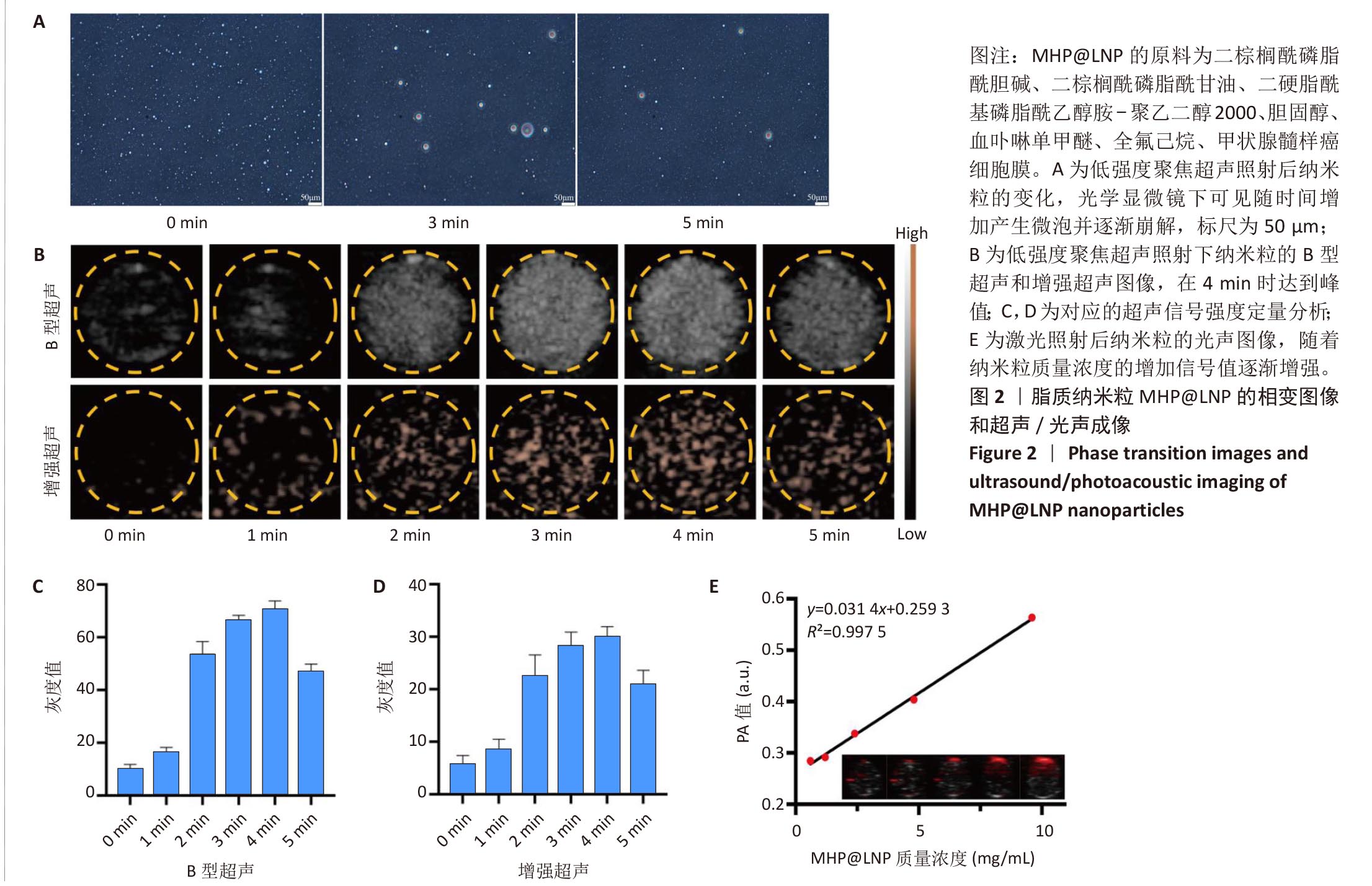
双模态成像能力:PFH在低强度聚焦超声LIFU)作用下发生相变形成微泡,使超声信号显著增强;
HMME具备优良光声信号,与质量浓度呈线性关系。
同源靶向+免疫逃逸能力:癌细胞膜涂层促进MZ-CRC-1细胞对纳米粒显著增强的摄取,并降低免疫系统识别。
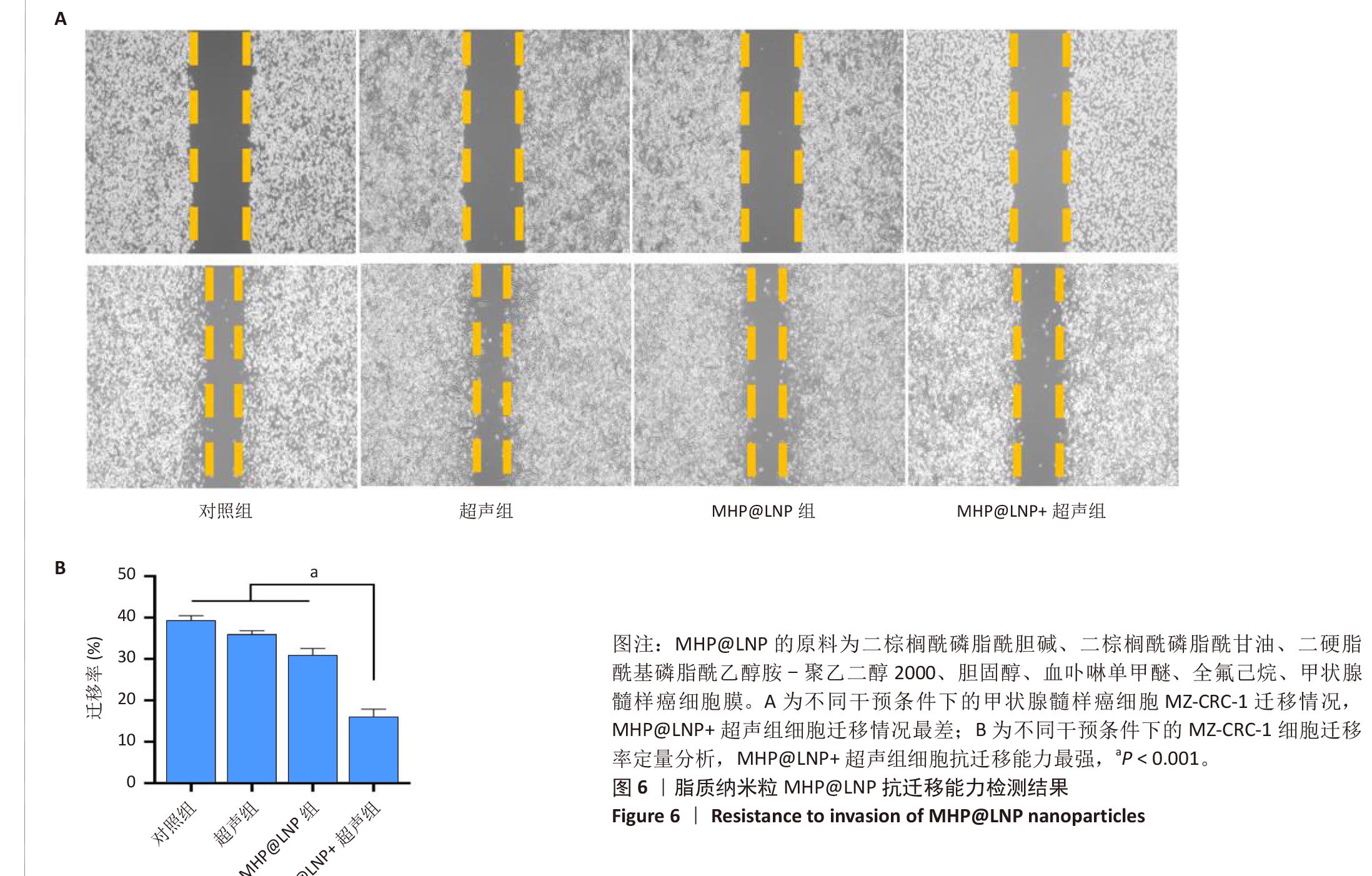
可控声动力治疗:LIFU触发后产生大量ROS杀伤肿瘤细胞,显著抑制MTC细胞迁移。
该研究验证了LNP体系在MTC治疗中的高潜力,也为临床可视化声动力疗法奠定了技术基础。
中新康明:提供专业的LNP原料、仿生纳米系统开发与肿瘤治疗CDMO服务
依托行业领先的脂质材料开发平台与制剂工程体系,中新康明长期为学术机构和生物医药企业提供专业的脂质纳米载体原料、定制化递送系统开发和制剂CDMO服务。针对甲状腺髓样癌及其它实体瘤方向,公司具备以下能力布局:
1.多类型脂质原料供应:适用于仿生纳米粒与声动力体系
可提供包括但不限于:
二棕榈酰磷脂酰胆碱(DPPC)
二棕榈酰磷脂酰甘油(DPPG)
DSPE-PEG2000
胆固醇
相变材料(如PFH)
声敏剂兼光敏剂负载体系工艺开发
细胞膜来源材料分离与纳米膜融合技术验证
2.LNP及仿生纳米系统CDMO服务:从概念到中试的全链路支持
中新康明提供从早期研究到IND申报前关键制剂工艺的整体解决方案,包括:
处方设计与高通量筛选
纳米粒构型核壳结构、膜包覆、复合体系)开发
相变材料负载与声响应体系优化
酸敏、温敏、声敏等刺激响应功能设计
质控体系审计:粒径、电位、蛋白谱、包封率、释放曲线
小试到中试规模化制备
GLP前制剂批次支持
依托先进设备,公司可支持声动力治疗用纳米材料的连续化、规模化制备,为企业加速创新技术转化。
中新康明技术优势:聚焦创新脂质纳米药物递送平台
1.LNP核心工艺深耕,与国际标准接轨
公司掌握微流控、薄膜水合、纳米混配等多工艺路线,可稳定实现粒径可控、分布窄、包封率高的LNP体系。
2.仿生细胞膜纳米系统开发经验成熟
支持各种来源细胞膜肿瘤、免疫、干细胞等)的提取、融合、膜蛋白分析及纳米体系构建,已成功交付多种实体瘤方向仿生纳米材料。
3.声动力/光声成像联用体系开发能力
公司开发表征流程包括:
超声相变检测
光声成像性能测试
ROS产生活性评价
定向细胞摄取、免疫逃逸验证
满足声动力/光声成像相关纳米制剂的全流程研发需求。
4.快速交付体系与法规咨询配套
为创新机构提供快速样品交付、工艺验证报告、CMC文件初稿,助力产品进入临床路径。
相关案例:肿瘤仿生纳米药物递送体系成功转化
凭借深厚的纳米材料开发基础,中新康明已支持多项高校与企业合作项目,包括:
光动力/声动力联合治疗用脂质纳米粒平台开发
肿瘤来源细胞膜包覆的多靶向复合纳米系统
纳米相变材料的声触发释放模型构建
适用于肺癌、乳腺癌、甲状腺癌等方向的多模态成像LNP制剂
多个项目顺利完成从探索性研究到中试放大的过渡,为后续动物实验与临床前研究奠定基础。
参考文献:“双模态成像仿生纳米粒对甲状腺髓样癌的声动力治疗”
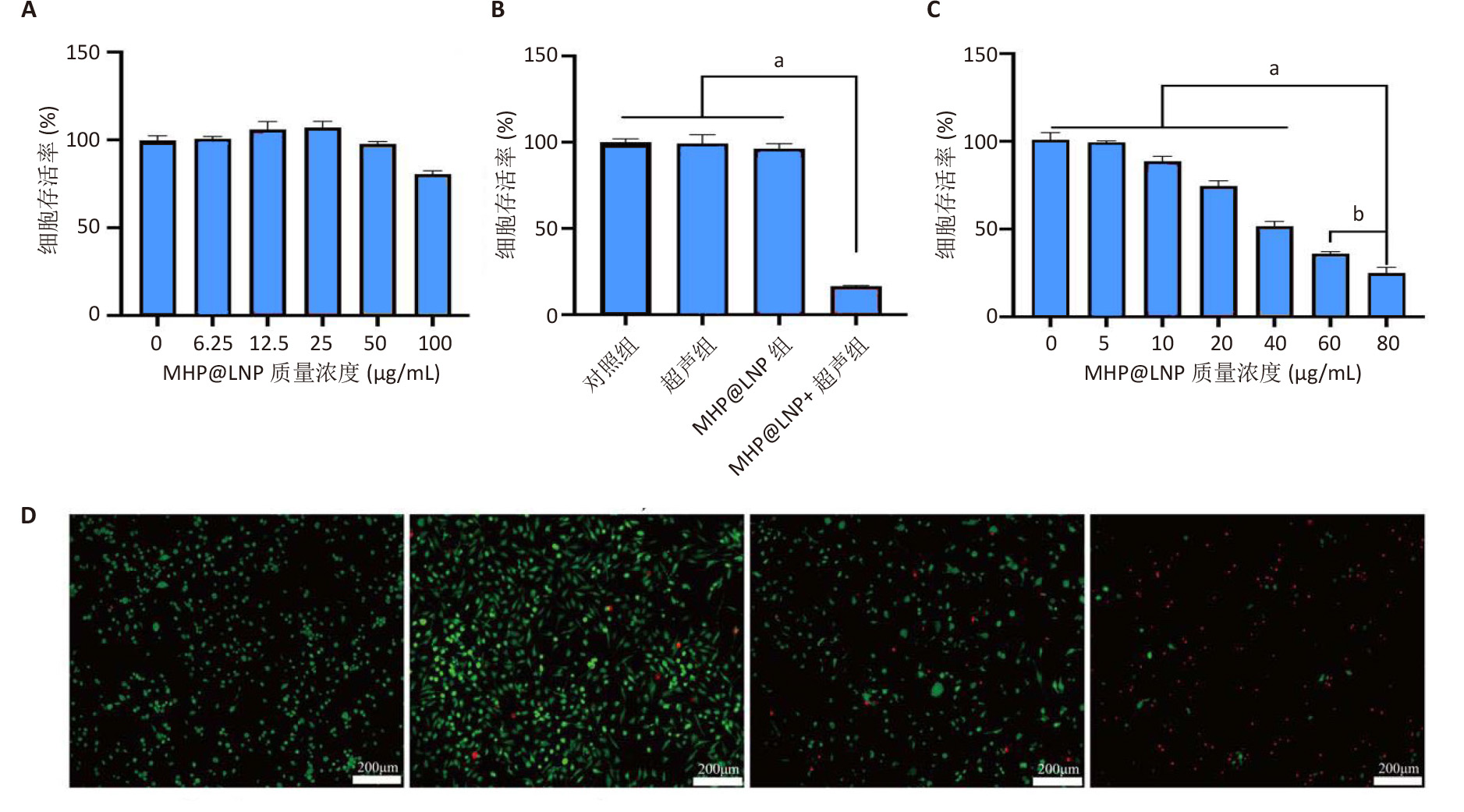
文献节选:制备具有双模态成像能力的仿生癌细胞膜涂层脂质纳米粒,检测纳米粒的理化性质、靶向能力、成像效果、细胞毒性和抗迁移能力。方法:以二棕榈酰磷脂酰胆碱、二棕榈酰磷脂酰甘油、二硬脂酰磷脂酰乙醇胺-聚乙二醇2000、胆固醇、血卟啉单甲醚、全氟己烷为原料,通过薄膜水合-超声振荡法制备脂质纳米粒HP@LNP,其中血卟啉单甲醚装载于脂质纳米结构的疏水层,全氟己烷装载于脂质纳米结构的亲水核心层内;将甲状腺髓样癌细胞膜包覆于脂质纳米粒HP@LNP表面,构建具有主动靶向甲状腺髓样癌细胞能力的仿生脂质纳米粒MHP@LNP。表征纳米粒MHP@LNP的理化性质、靶向能力、免疫逃逸能力、成像效果、细胞毒性和抗迁移能力。结果与结论:①脂质纳米粒MHP@LNP呈现典型的核壳结构,粒径为131.06 nm,平均电位为-30.59 mV,凝胶电泳结果显示脂质纳米粒MHP@LNP与癌细胞膜蛋白图谱相符合,荧光共定位结果显示脂质纳米粒MHP@LNP与癌细胞膜的荧光信号显著重合。脂质纳米粒MHP@LNP纳米粒内血卟啉单甲醚的包封率为87.8%,载药率为14.6%。在低强度聚焦超声刺激下,脂质纳米粒MHP@LNP可发生相变产生微泡,在4 min时超声信号强度达到最大值。在激光照射下,脂质纳米粒MHP@LNP的光声信号强度与其质量浓度呈现线性相关。脂质纳米粒MHP@LNP具有同源细胞靶向能力和免疫逃逸能力。未经低强度聚焦超声照射前的脂质纳米粒MHP@LNP具有良好的生物相容性,而经低强度聚焦超声照射后产生具有细胞毒性的活性氧,有效杀伤甲状腺髓样癌细胞,并抑制甲状腺髓样癌细胞的迁移能力。②结果表明,脂质纳米粒MHP@LNP能够在超声和光声双模态成像引导下实现声动力治疗,用于治疗甲状腺髓样癌。
总结:助力甲状腺髓样癌治疗技术落地,中新康明赋能创新转化
以MHP@LNP为代表的新型仿生脂质纳米平台,为MTC的精准诊疗提供了兼具靶向性、可视化程度高、治疗可控性强的解决路线。从材料构建、成像评估到声动力治疗,该研究展示了脂质纳米系统在实体瘤综合治疗中的巨大潜力。
面向未来,中新康明将持续布局更前沿的LNP递送材料、仿生纳米体系与声/光可视化治疗平台,以专业的结构设计能力、产业化制备技术及全流程CDMO服务,支持甲状腺髓样癌及更多实体瘤领域的创新药物和诊疗技术快速落地。
欢迎科研机构、药企与我们进一步合作,共同推动肿瘤诊疗技术的升级与临床转化。
 返回
返回