胰腺癌(Pancreatic Cancer,PC)是目前临床治疗难度最高、预后最差的实体肿瘤之一。其起病隐匿、进展迅速、对传统化疗耐药性强,导致患者总体五年生存率长期处于较低水平。尽管吉西他滨、FOLFIRINOX等方案在一定程度上延长了患者生存期,但系统毒性大、多药耐药和疗效平台期等问题依然突出。中新康明通过前药化与纳米化的双重策略,构建了以mPEG-CSO为骨架、RG3通过席夫碱键共价接枝、并进一步包载Cel的两亲性纳米颗粒体系。所得纳米颗粒粒径约124nm,表面电位为−39.89mV,兼具良好的体内循环稳定性与肿瘤被动靶向能力。在肿瘤微酸性环境中,席夫碱键发生水解,实现RG3的响应性释放,同时Cel随纳米结构解体而释放,从而在肿瘤部位实现时空协同给药。
一、关键功能原料:胰腺癌纳米制剂构建的底层保障
1.mPEG-NHS:PEG化修饰的核心活性原料
在胰腺癌纳米制剂中,PEG化是延长循环时间、降低单核吞噬系统清除、提升肿瘤富集能力的关键策略。中新康明可稳定供应多规格mPEG-NHS(甲氧基聚乙二醇-活性酯)原料,广泛适用于壳聚糖、多肽、小分子及天然产物的共价修饰。
中新康明提供的mPEG-NHS具有高偶联活性、低游离PEG残留、批次一致性好等特点,可满足从实验室研究到中试放大、乃至GMP转化阶段对质量稳定性的严格要求。在胰腺癌纳米体系中,mPEG-NHS常作为PEG链引入的关键中间体,直接决定载体的亲水壳层构建效率与体内行为。
2.mPEG-CSO:纳米载体骨架的成熟解决方案
针对胰腺癌药物递送中“高毒性小分子+生物相容性载体”的设计需求,中新康明重点布局了mPEG-CSO(PEG化壳聚糖寡糖)系列材料。该类材料兼具壳聚糖良好的生物相容性与PEG的“隐形”效应,是构建聚合物纳米颗粒、前药纳米体系的重要基础。
中新康明可根据项目需求,定制不同分子量、不同PEG接枝度的mPEG-CSO,用于自组装纳米颗粒、药物包载或前药化设计,显著改善胰腺癌候选药物的溶解度、稳定性及体内分布特征。
3.mPEG-CSO-RG3等前药载体的定制合成服务
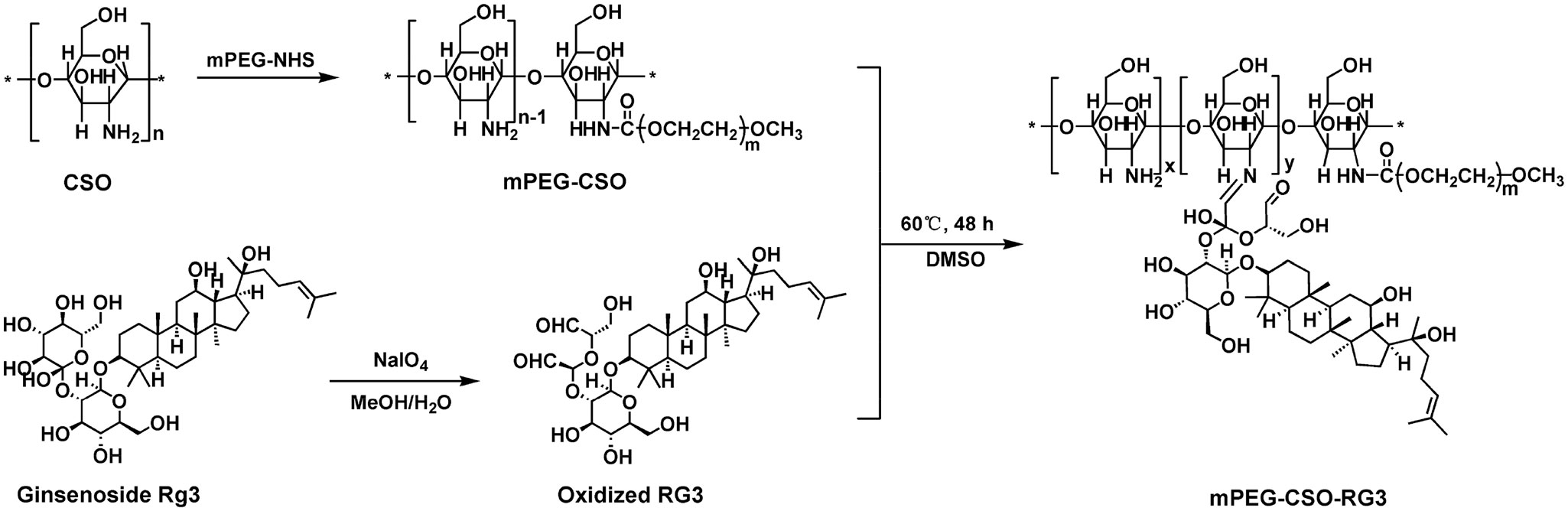
围绕近年来备受关注的“前药型纳米制剂”方向,中新康明可提供mPEG-CSO-RG3等复杂前药载体的定制合成与工艺优化服务。通过席夫碱键、酯键等可响应化学连接方式,将人参皂苷Rg3等功能分子共价接枝至聚合物骨架中,实现:
肿瘤微环境(酸性)触发释放
药物协同增效与减毒
纳米体系结构与功能的一体化设计
该类前药载体在胰腺癌纳米制剂中,可同时承担载体、协同治疗组分及响应释放模块的多重角色,是当前创新纳米药物的重要发展方向。
二、制剂CDMO:从配方设计到可转化工艺的系统能力
1.胰腺癌纳米制剂的处方与工艺开发
中新康明在纳米制剂CDMO领域,具备成熟的聚合物纳米颗粒、前药纳米颗粒、自组装体系开发经验。针对胰腺癌药物特点,中新康明可从早期即参与处方设计,系统优化以下关键参数:
粒径与粒径分布(EPR效应友好区间)
表面电位与血液相容性
包封率与载药量
释放动力学与pH响应行为
稳定性与储存条件
通过工艺路径设计,确保纳米制剂不仅“做得出来”,更能“放得大、控得稳、用得久”。
2.完整的理化与功能性数据检测支持
为满足胰腺癌纳米制剂在临床前研究及申报阶段的合规需求,中新康明可同步提供系统化的数据检测与表征服务,包括但不限于:
粒径、PDI、Zeta电位分析
载药量、包封率及批次一致性评估
体外释放曲线(不同pH条件)
稳定性研究(溶液、血清、不同温度)
血液相容性与溶血试验
这些数据可直接用于支持药效学、安全性研究及后续IND申报资料准备。
3.面向转化的工艺放大与质量研究
区别于单纯科研型服务,中新康明在CDMO阶段即强调转化导向。针对胰腺癌纳米制剂项目,公司可同步考虑工艺放大、质量控制及法规可行性,降低后期从实验室到产业化过程中的技术重构风险。
通过对关键工艺参数(CPP)与关键质量属性(CQA)的系统研究,帮助客户建立稳定、可复制的纳米制剂生产路径。
三:中新康明从材料化学到制剂工程的系统整合
中新康明在胰腺癌及其他实体瘤纳米制剂领域的核心优势,体现在对“材料—结构—功能—工艺”的整体把控能力。公司不仅具备PEG衍生物、多糖载体及天然产物前药的化学合成能力,同时在纳米自组装、薄膜水化、超声分散与过滤纯化等关键工艺节点形成了可放大的技术路径。
在类似mPEG-CSO-RG3/CelNPs的体系中,对粒径窗口、表面电性及释放动力学的精细调控,直接关系到体内分布和安全性。中新康明通过成熟的工艺放大与质量控制体系,可有效降低从实验室配方到中试、放大生产过程中的不确定性,为客户缩短研发周期、降低技术风险。
参考文献:“Synergistic effect of pH-sensitive PEGylated RG3-chitosan prodrug nanoparticles encapsulated celastrol on pancreatic cancer”
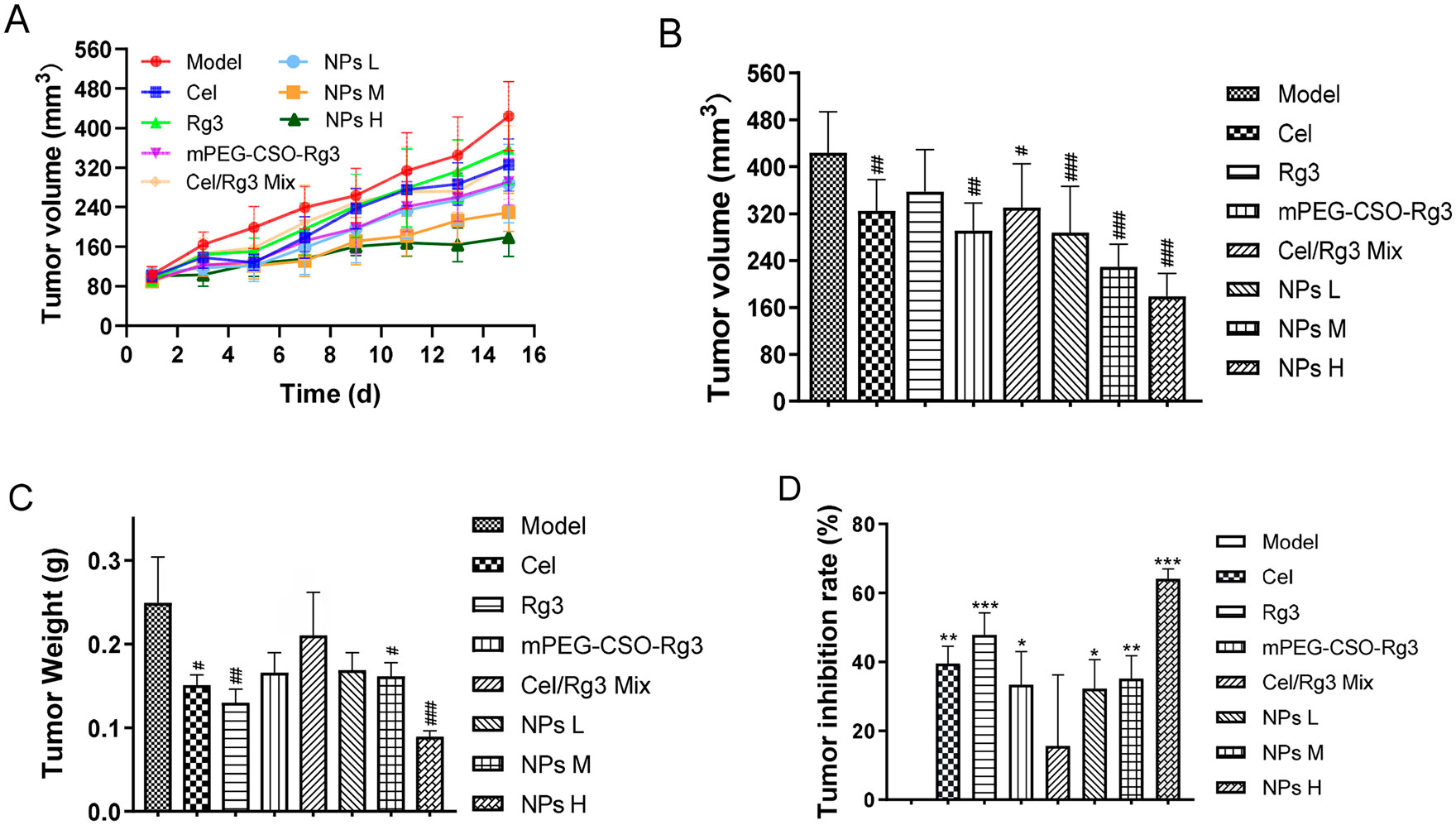
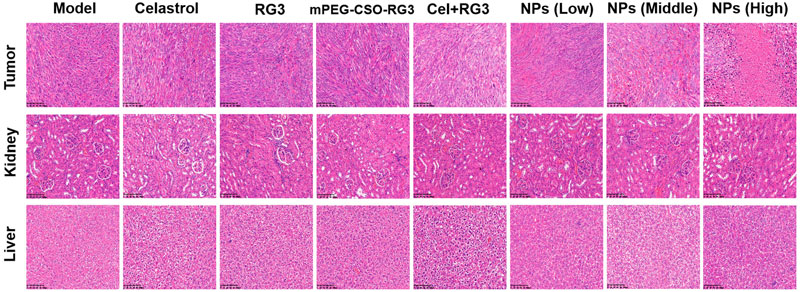
文献节选:雷公藤红素(Cel)是一种潜在的抗癌治疗候选药物,但其实际应用受限于溶解度低、肿瘤选择性差以及细胞毒性等问题。临床上,人参皂苷 Rg3(RG3)通常与化疗药物联合使用,以增强抗肿瘤效果并减少副作用。在此,我们开发了一种新型的 pH 敏感型前药纳米颗粒(NPs),其中包含 RG3 和 Cel,用于协同治疗胰腺癌(PC)。两亲性前药是一种聚乙二醇化的壳聚糖寡糖,通过席夫碱键与 RG3 相连,与疏水性的 Cel 自组装形成纳米颗粒,其载药量分别为 2.12%(Cel)和 1.63%(RG3)。纳米颗粒表现出合适的粒径(124.01 纳米)、电位(-39.89 毫伏)以及良好的物理稳定性。此外,纳米颗粒在酸性环境中席夫碱键水解时还表现出可控的药物释放特性。在 Pan02 肿瘤荷瘤小鼠模型中,纳米颗粒在肿瘤组织中表现出高积累,并延长了血液循环时间。此外,与游离的 Cel、RG3、前药以及 Cel + RG3 相比,纳米颗粒能更有效地抑制肿瘤生长并降低全身毒性。结果表明,这些纳米颗粒能够为前列腺癌治疗提供一个安全且前景广阔的纳米平台。
总结:助力胰腺癌纳米药物从“设计”走向“临床”
在胰腺癌这一高度未满足临床需求的领域,纳米制剂与前药策略正成为推动创新治疗的重要力量。中新康明通过关键功能原料供应+定制化前药合成+纳米制剂CDMO服务的深度整合,为胰腺癌纳米药物研发提供了从材料到制剂、从概念到转化的系统支持。
未来,中新康明将持续围绕纳米递送与复杂制剂技术平台,携手科研机构与创新药企业,加速更多胰腺癌创新纳米药物迈向临床应用阶段。
 返回
返回