肝细胞癌(Hepatocellular carcinoma,HCC)仍然是全球发病率与死亡率最高的恶性肿瘤之一。由于早期症状隐匿、肿瘤异质性强、传统治疗方式局限明显,HCC始终是全球医学界面临的重大挑战。近年来,随着基因治疗技术的快速发展,长链非编码RNA(longnon-coding RNA,lncRNA)被证实在HCC的发生、进展与药物耐受中扮演关键调控角色,逐渐成为精准治疗中的潜力靶点。如何安全、高效地将lncRNA输送至肿瘤部位,成为推动该疗法临床化的核心瓶颈。
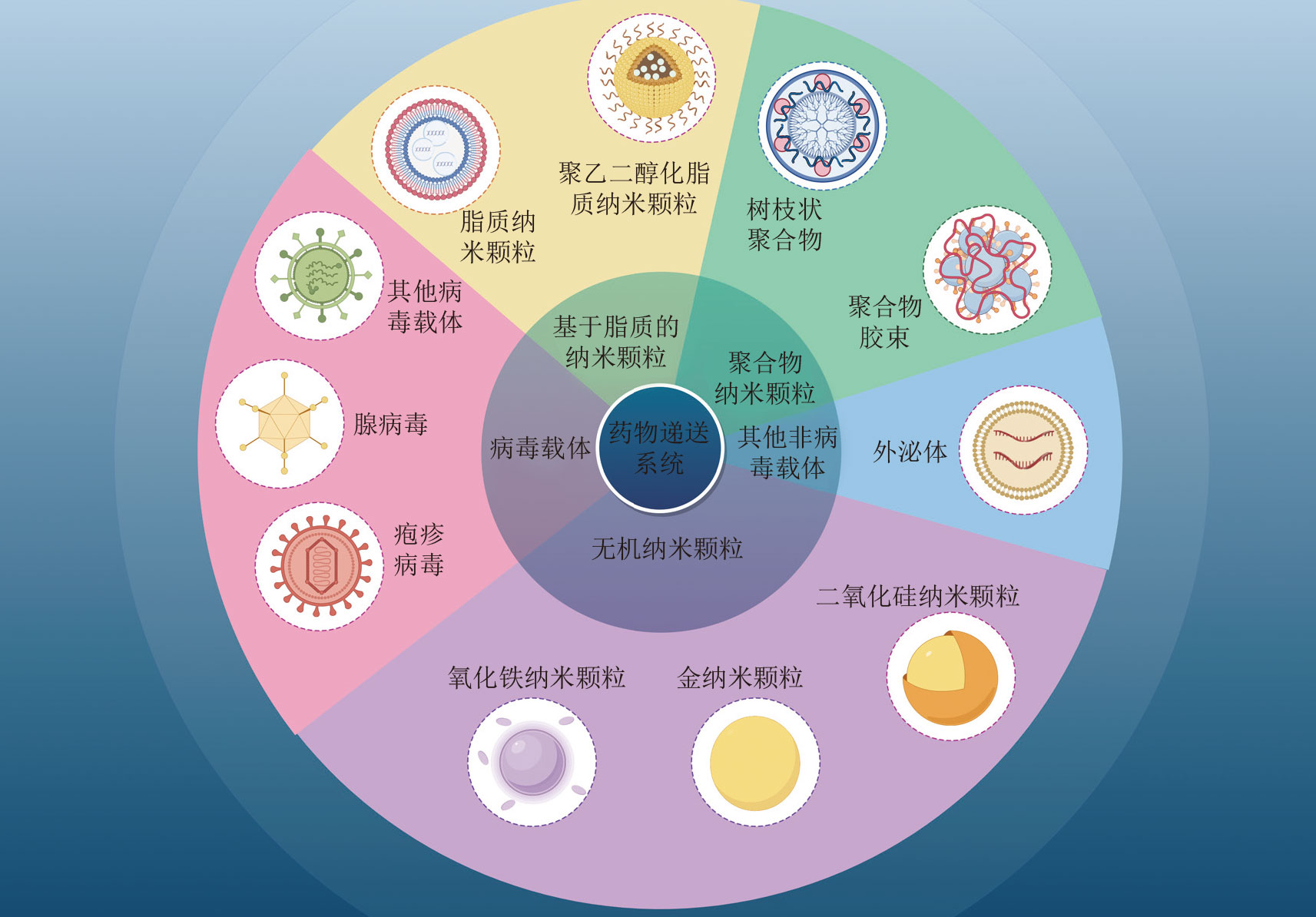
纳米颗粒载体(Nanoparticles,NPs),尤其是脂质纳米颗粒(Lipid Nanoparticles,LNPs),凭借优秀的核酸保护能力、细胞摄取效率及可调控的组织靶向性,正在解决这一关键障碍。NPs能显著提高lncRNA稳定性、促进内体逃逸,并实现对肿瘤组织的精准递送,为HCC靶向治疗带来了前所未有的可能性。
在此背景下,中新康明凭借领先的LNP原料体系、核酸递送平台与专业制剂CDMO能力,为科研与产业界提供从分子设计到工艺放大、再到临床级制剂开发的全流程解决方案,为HCC乃至更广泛实体瘤的基因治疗创新提供坚实支撑。
肝细胞癌治疗的前沿:从lncRNA功能研究走向临床级递送方案
随着大量研究揭示lncRNA在细胞增殖、侵袭、转移、免疫调控、药物敏感性等方面的深度参与,lncRNA已成为多条HCC信号通路的关键节点。例如:
部分lncRNA可激活肿瘤促增殖通路,促进肝癌进展
部分具有抑癌功能的lncRNA在HCC中下调,为治疗提供干预机会
lncRNA对肿瘤免疫微环境产生调控,可作为免疫治疗增敏工具
然而其结构长度大、易被降解、难跨膜、体内稳定性差,使得直接给药难以发挥作用。因此,只有通过先进的纳米载体平台实现稳定封装、精准递送与可控释放,lncRNA才能真正走向临床应用。
脂质纳米颗粒(LNP)是当前最成熟的核酸递送技术路线之一。经验证,LNP可显著提升lncRNA的体内稳定性,并实现靶向肝脏或肿瘤的可调控分布,在HCC治疗中具有天然优势。随着制剂工程、材料科学和靶向化技术的突破,LNP-lncRNA联合治疗正逐步成为未来肝癌精准治疗的新方向。
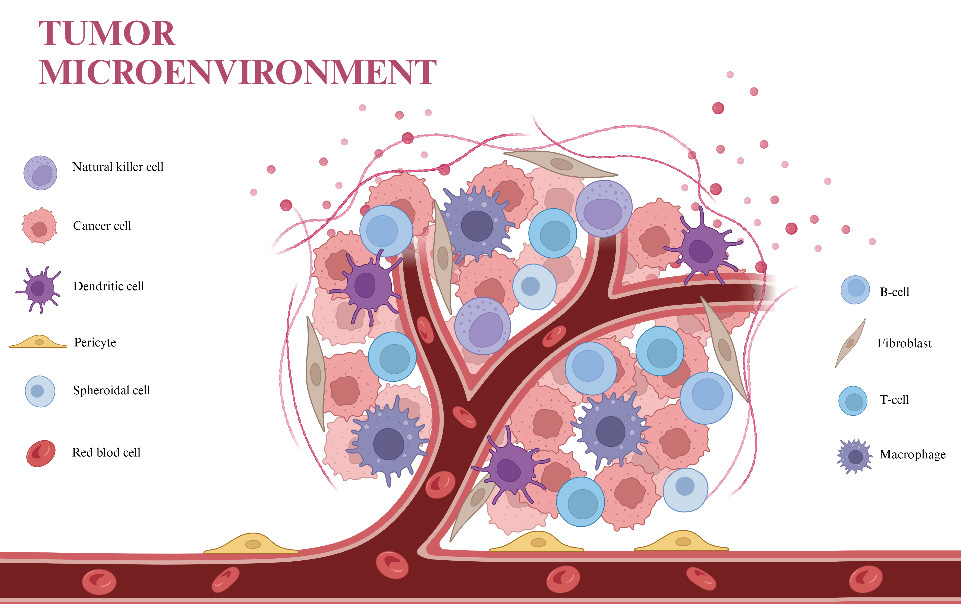
中新康明:提供HCC基因治疗所需的LNP原料产品与端到端CDMO服务
围绕HCC靶向治疗的需求,中新康明已构建涵盖“功能脂质原料+LNP制剂平台+质量标准体系+工艺放大”的一体化技术链条,可全面支持lncRNA、mRNA、siRNA等核酸药物的开发。
可供应的LNP关键原料包括:
可电离脂质(Ionizable lipids):适配大片段核酸(如lncRNA)
辅脂质(DSPC、DOPE等)
结构脂质(PEG-lipid系列)
胆固醇及修饰性胆固醇
靶向配体修饰材料(GalNAc、RGD、多糖修饰等)
所有原料均可提供研发级–中试级–GMP级别,并具备可追溯、可验证的质量体系,满足临床前与临床递送研究需求。
CDMO服务范围覆盖:
核酸药物(lncRNA/mRNA/siRNA)序列优化与修饰选择
LNP配方筛选、包封效率提升、粒径/分布/稳定性优化
微流控工艺开发与放大
稳定性研究与质量控制体系建立
毒理样品、IND申报用批次生产
包材选择、储存条件开发、运输验证
通过成熟的核酸递送平台,中新康明可实现从实验构思到临床级制剂的完整闭环。
中新康明的技术优势:为高复杂度核酸如lncRNA递送而生
1.针对大分子核酸的专用LNP工艺体系
lncRNA结构复杂、分子量高,封装难度显著高于mRNA和siRNA。中新康明针对性构建了可电离脂质筛选库与结构优化体系,确保大分子核酸在保持结构完整性前提下仍具备高包封率与稳定性。
2.稳定可控的微流控制剂平台
自研微流控设备可实现精确N/P调控、颗粒度控制(<100nm)、可重复制备,为后续放大奠定可靠基础。
3.肿瘤靶向递送策略布局完善,可提供:
肿瘤微环境响应载体(pH响应/ROS响应)
受体靶向配体(如针对HCC的ASGPR、GPC3等)
表面修饰策略以提高肿瘤浸润效率
为HCC靶向递送提供更高层级的可行性。
4.从研究到IND的一站式交付能力
涵盖处方开发、工艺转移、GMP生产、申报文件支持,实现高效研发周期与可监管路径。
典型开发案例:LNP-lncRNA在实体瘤基因治疗中的验证成果
在多个战略合作项目中,中新康明已成功帮助合作伙伴实现:
案例:lncRNA-LNP用于肝癌细胞增殖抑制
基于特定抑癌型lncRNA,开发团队完成了:
高稳定性LNP配方构建
包封率>90%
有效提升肿瘤细胞内递送量
在小动物模型中观察到显著肿瘤生长抑制
案例2:HCC靶向化LNP的配体修饰探索
通过对可电离脂质和GalNAc修饰策略的组合筛选,实现对肝脏与肿瘤组织的差异化分布调控,为HCC精准递送奠定工程基础。
这些成果验证了LNP-lncRNA体系在实体瘤基因治疗中的巨大潜力,也形成了可持续扩展的技术平台。
参考文献:“基于纳米颗粒和长链非编码RNA靶向治疗肝癌的研究进展”
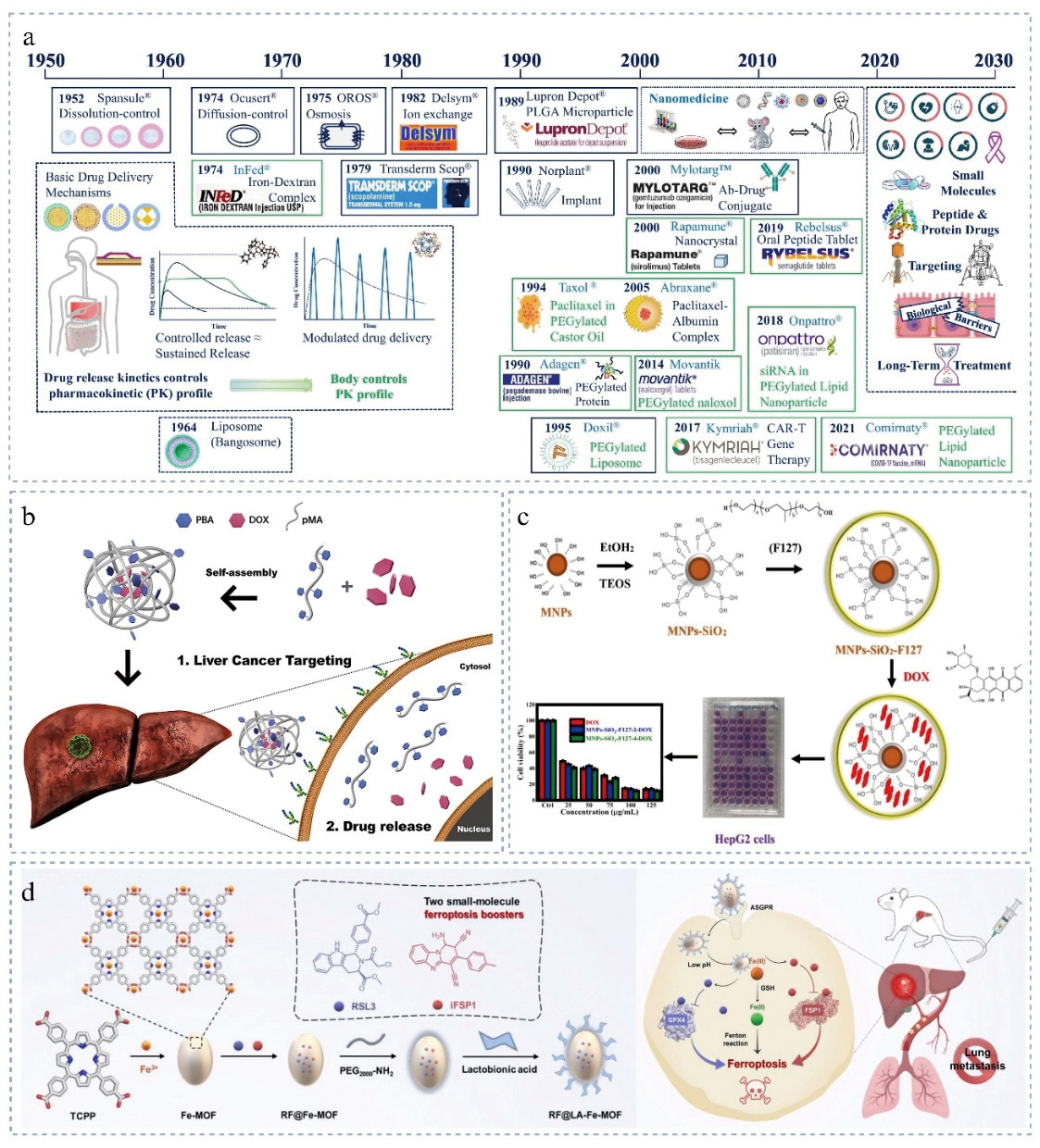
文献节选:有机纳米颗粒根据基础材料的理化性质可以分为脂质纳米颗粒 (Lipid nanoparticle, LNP)、 多 糖 纳 米 颗 粒 (Polysaccharide based nanoparticle,PSNP)、 肽或蛋白质纳米颗粒(Peptide/protein-based nanoparticle,PNP)和合成聚合物(Synthetic polymer-based nanoparticles,SNP). 各种基于有机纳米颗粒的药物递送系统各有优势,比如脂质纳米载体具有低毒性和易于细胞摄取、良好的生物相容性等优点,在癌症治疗中发挥重要作用. LNP由脂质和磷脂组成,脂质壳能够保护封装的药物免受酶的降解,有效保护和递送生物活性分子,其效率取决于平均尺寸、膜装料量、负载效率和多分散指数。研究表明,LNP 的结构影响其在体内的应用,通过优化 LNP 的结构,可以增强其稳定性,减少多分散性和大小变化,并改善DNA装载能力。
结语:助力肝细胞癌核酸治疗迈向产业化,中新康明持续赋能科技创新
随着lncRNA功能研究不断深入,基于lncRNA的肝癌治疗技术正迎来新的机遇期。纳米递送体系,尤其是LNP的成熟与可工程化,为这类核酸分子的体内应用创造了全新的可能性。
中新康明将继续依托自身在脂质纳米颗粒原料体系、核酸递送工程、制剂工艺放大、临床申报支持等方面的技术优势,为更多科研机构、生物医药企业提供专业、可靠、可落地的解决方案。
未来,我们将持续推进LNP技术平台在肝癌、实体瘤、免疫治疗等领域的落地应用,加速高潜力核酸药物从实验室走向临床,让创新疗法更快惠及患者。
 返回
返回