在医药研发领域,HSA-PLGA(人血清白蛋白-聚乳酸-羟基乙酸共聚物)粒子作为一种新型的药物递送与控释平台,正在引起越来越多的关注。其独特的生物相容性、可降解性以及与药物的良好相容性,使其在药物递送系统中展现出广泛的应用前景。
一、稳定性与生物相容性的优势
HSA作为一种天然蛋白质,具有良好的生物相容性和低免疫原性。将其与PLGA共聚,形成HSA-PLGA粒子,不仅保留了HSA的生物相容性,还赋予了PLGA粒子更好的稳定性和生物降解性。这种组合使得HSA-PLGA粒子在体内能够缓慢降解,释放药物,从而减少了药物的毒副作用,提高了治疗效果。
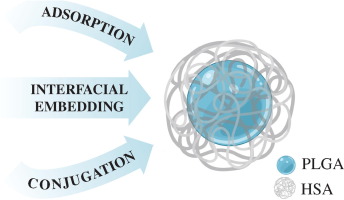
在这一方面,中新康明能够制备和定制不同粒径和结构的白蛋白纳米粒产品,并且支持药物修饰与包裹的开发研究,帮助药物在体内更稳定地发挥作用。
1. 初始处方设计
根据药物理化性质(疏水性、分子量、稳定性)选择最佳 PLGA 分子量、乳酸/羟基乙酸比例;
确定 HSA 包覆策略(物理吸附、化学偶联或自组装包覆),提高粒子稳定性与靶向性;
针对小分子药物、蛋白药物及核酸药物设计不同的包封与释放方案。
2. 关键工艺参数优化
乳化/纳米沉淀条件优化:通过调节溶剂种类、搅拌速率、表面活性剂浓度控制粒径分布与 PDI;
药物包封率与载药量提升:优化油相/水相比例及药物预处理方式,提升药物稳定性与载入效率;
释放曲线调控:通过改变 PLGA 降解速率与 HSA 包覆层厚度,实现速释/缓释的个性化调整。
3. 表面功能化策略
HSA 偶联与修饰:通过 HSA 结合改善血液循环半衰期,增加肿瘤靶向性;
靶向配体修饰:可进一步结合抗体、肽段或多糖实现精准递送;
稳定性提升:HSA 表面层能显著减少 opsonization,提高血浆稳定性与免疫逃逸能力。
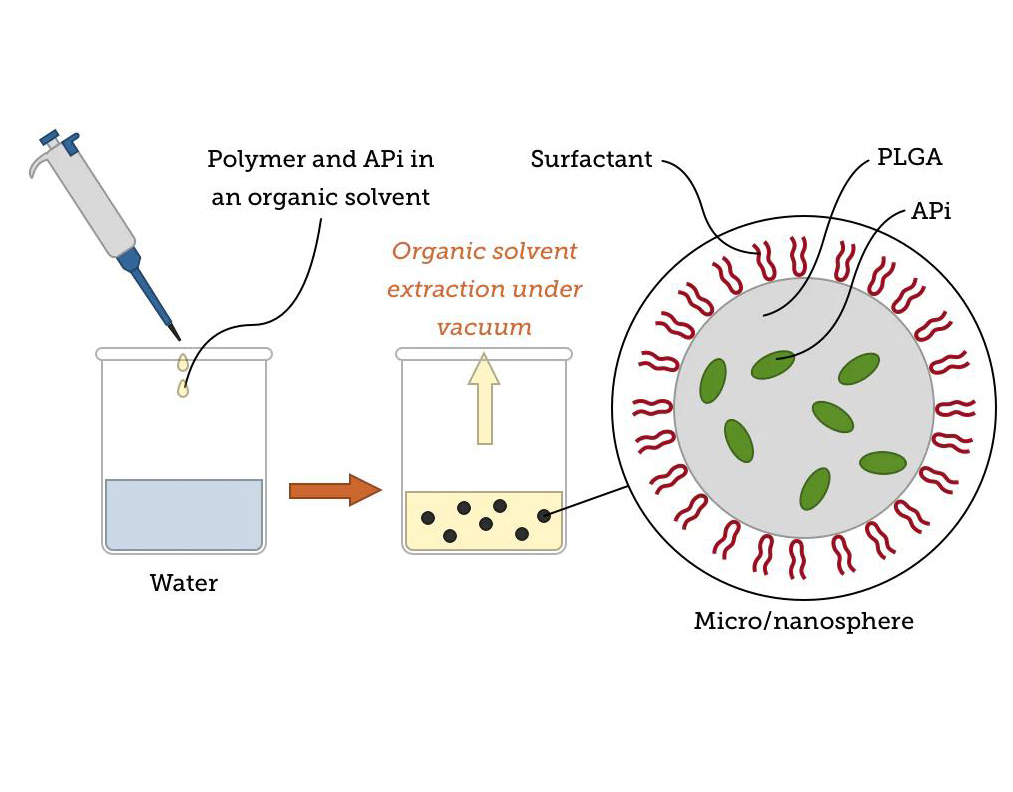
4. 处方筛选与评价
理化参数检测:粒径、PDI、Zeta 电位;
体外药物释放实验:评估不同处方的释放曲线特征;
稳定性测试:温度、pH、冻干/复溶稳定性;
生物相容性验证:细胞毒性、血液相容性实验。
5. 工艺可放大性验证
确保优化后的处方在 实验室级—中试级—GMP 级之间具备可转化性;
提供工艺转移与放大生产的可行性评估报告,缩短临床前开发周期。
二、临床前景与应用展望
目前,HSA-PLGA粒子在药物递送系统中的应用仍处于研究阶段,但其在提高药物稳定性、控制药物释放速率、实现靶向递送等方面的优势,使其在未来的临床应用中具有广阔的前景。随着研究的深入,HSA-PLGA粒子有望成为一种理想的药物递送平台,应用于抗肿瘤、疫苗递送、蛋白质药物递送等多个领域。
中新康明也在这一方向持续深耕,能够围绕医药研发提供整体化服务,助力科研成果从实验室走向实际应用。
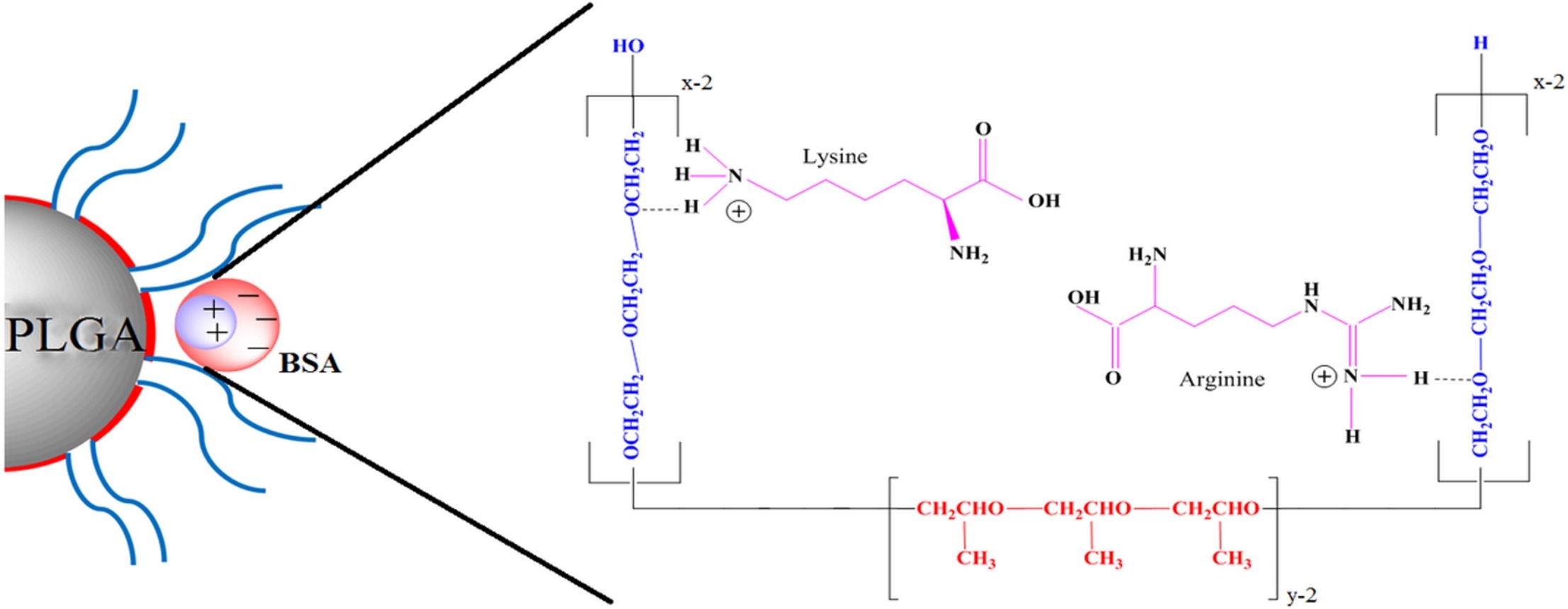
总之,HSA-PLGA粒子作为一种新型的药物递送与控释平台,凭借其优异的性能和广泛的应用前景,正在成为医药研发领域的研究热点。随着相关研究的不断深入,加上产业端的支持,它有望在未来的临床治疗中发挥重要作用,为患者带来更好的治疗体验。
三、应用案例
文献标题:ASODN-Protamine-HSA-PLGA纳米粒的构建及体外细胞核靶向的初步研究
摘要:目的研究新型非病毒载体ASODN-Protamine-HSA-PLGA纳米粒的制备方法及其对体外细胞核靶向的可能性。方法用鱼精蛋白硫酸盐(protamine sulfate)和人血清白蛋白(HSA)缩合反义寡核苷酸(ASODN),再以聚丙交酯乙交酯(PLGA)作为载体材料,采用双乳化溶媒蒸发法制备载ASODN-Protamine-HSA-PLGA纳米粒(ASODN-P/H-PLGA-NP)。用透射电镜观察其形态;用激光粒度仪测定其粒径、多分散性和zeta电位;用两步法测定其包封率;用MTT法测定其毒性;用激光共聚焦显微镜观察其进入人喉颈鳞癌细胞(Hep-2)和靶向细胞核的能力。结果制备的纳米粒形态圆整,大小均匀,平均粒径为128nm,多分散系数(PDI)为0.234,平均zeta电位为-23.3mV,平均包封率为78.45%。
 返回
返回