近年来,LNP技术因mRNA疫苗(如COVID-19疫苗)迅速落地而备受关注。但正如最新科学研究指出,可电离脂质(ionizablelipid)对mRNA-LNP的体内药代动力学(PK)和生物分布(biodistribution)有显著影响——不同可电离脂质(如SM-102、ALC-0315、MC3)会显著改变LNP在血浆中的稳定性、mRNA保护、半衰期及蛋白表达的组织分布。这意味着,要设计出既安全、高效又表达持久的LNP配方,必须精细优化脂质类型、比例和工艺参数。
在这一背景下,中新康明宣布其LNP制剂CDMO服务全面升级,特别聚焦于核酸‑LNP(如mRNA-LNP、siRNA-LNP等)配方设计、工艺开发、载荷封装、粒径调控、分析表征以及从中试到商业化生产的闭环能力。借助其在脂质体、水凝胶等先进材料平台上的深厚经验,中新康明正成为国内外客户在抗癌、疫苗和基因治疗领域的战略合作伙伴。
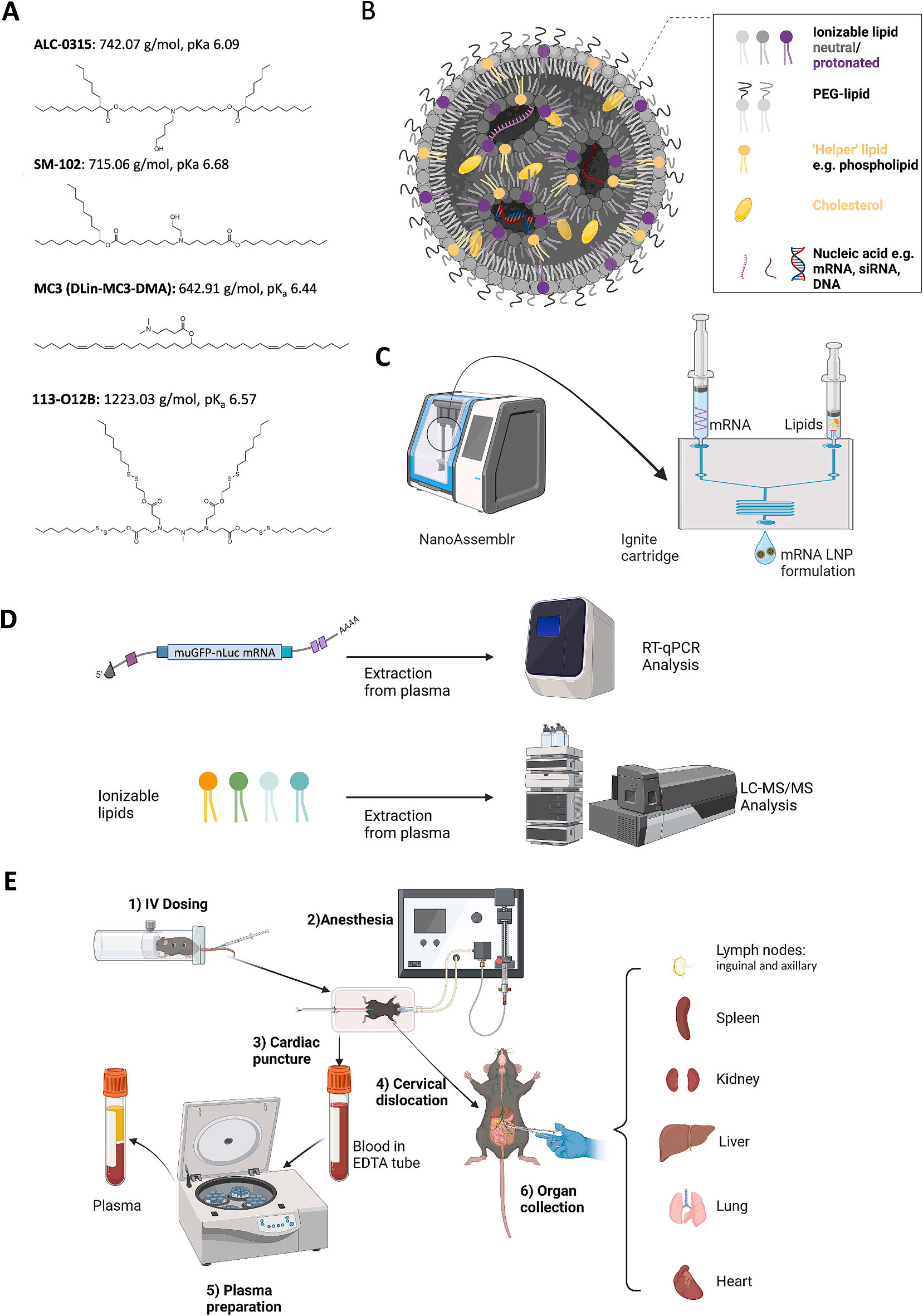
中新康明LNP制剂CDMO全流程服务
中新康明凭借其一体化CDMO平台,能够在以下关键环节为客户提供服务:
核酸-LNP配方设计
基于客户靶核酸(mRNA、siRNA等)特性(如大小、结构、稳定性)进行脂质类型选择,包括可电离脂质(ionizablelipids)、辅助脂质(helperlipids)、PEG-脂质等。
优化脂质配比,以实现高封装效率(encapsulationefficiency)、适合细胞摄取和内体逃逸的LNP结构。
采用质量设计(QualitybyDesign,QbD)原则,多点试验(例如混合–工艺实验设计)来建立稳定、可重复的配方体系。
工艺开发与中试优化
LNP制备工艺(如微混合器、微流控技术)的开发与验证,确保粒径(size)、多分散性(PDI)和封装效率达标。
粒径调控:调整工艺参数(流速比、浓度、注入方式)实现目标尺寸(如50–150nm),以优化药代动力学和细胞/组织分布。
中试放大:在损失最小化的前提下完成从实验室(mg–g级)到中试(十几克/几百克)的工艺放大。
封装效率及稳定性研究
精确测定封装效率(encapsulation%),使用荧光染料、荧光探针、核酸定量(如比色法、RiboGreen、RT-qPCR)等技术。
药剂稳定性评估:在不同储存条件(温度、pH、冷冻/液-氮)下评估LNP粒径、封装率和载荷完整性随时间变化。
冷冻/解冻循环、冻干-工艺开发与优化,以便长期储存和运输。
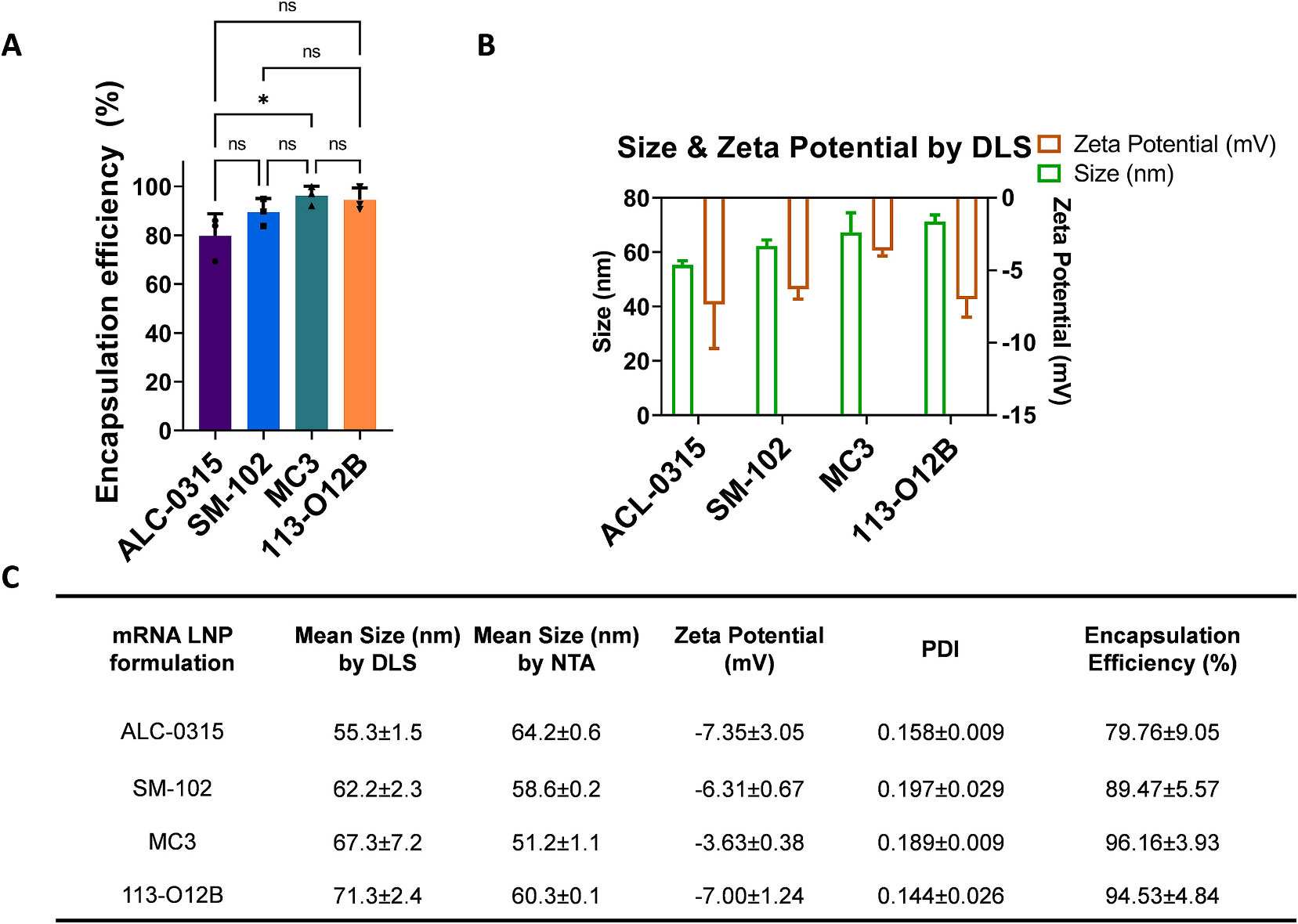
分析表征
粒径与分布(动态光散射DLS,纳米颗粒追踪分析NTA);
Zeta电位测定;
封装效率分析(前述方法);
内在结构表征(如透射电子显微镜TEM,冷冻电镜/cryo-EM);
生物分布、体外释放曲线,体外细胞转染效率及蛋白表达测试。
中试与商业化放大生产
GMP或接近GMP标准的中试工厂,可支持临床前和临床样品生产;
放大生产设施具备灵活性,可从中试(几百克)放大到商业化量级(kg级);
严格质量控制(QC)和质量保证(QA)体系,确保每批产品一致性、安全性和性能稳定。
临床和商业化注册支持
帮助客户准备IND(临床试验申请)所需的CMC(化学、制造和控制)文件;
支持GLP/GMP性能测试(稳定性测试、无菌检测、内毒素、纯度等);
提供后续商业化生产战略,包括放大规模、技术转移、供应链对接等。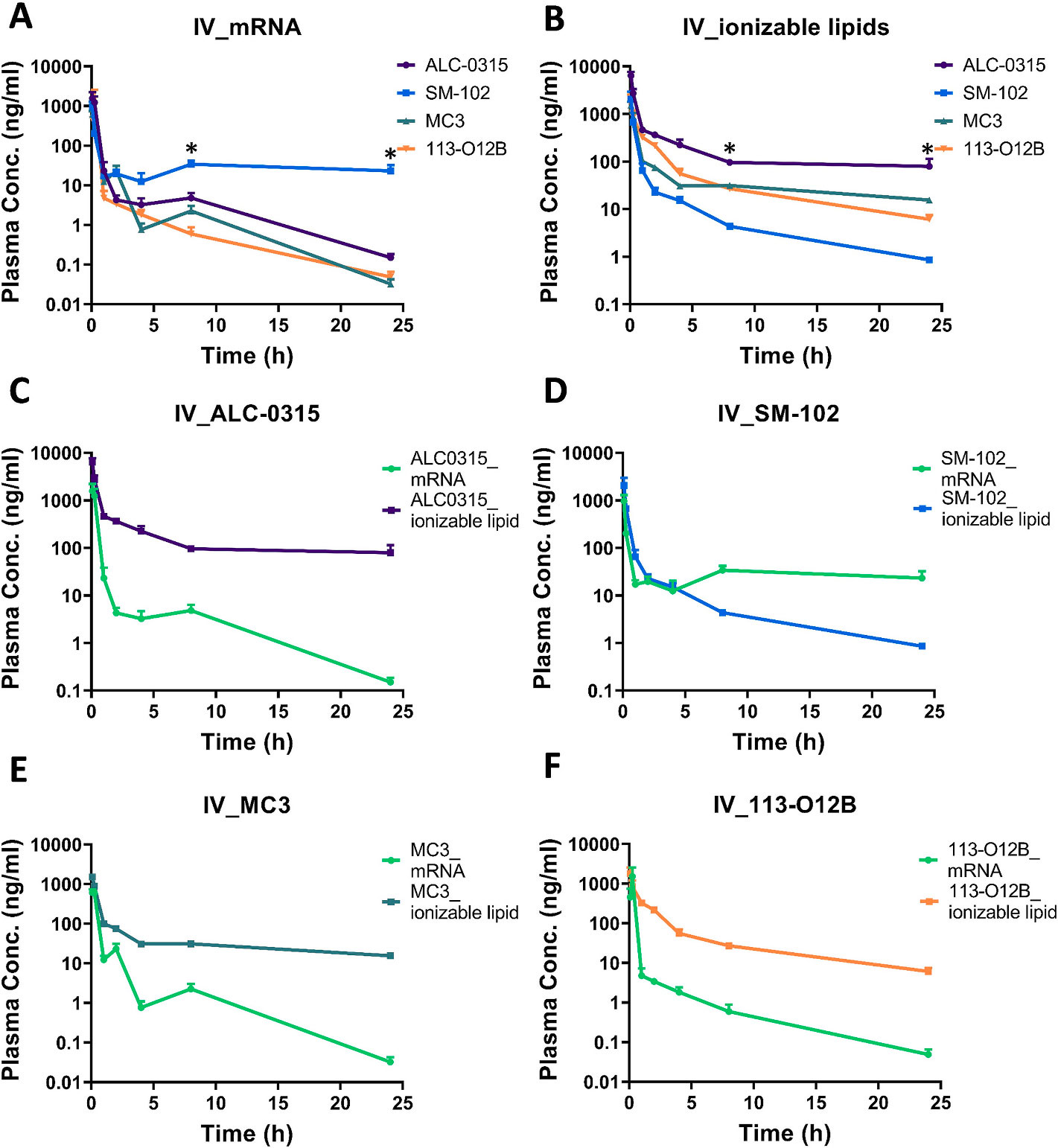
定制化服务&战略咨询
根据客户靶点(疫苗、基因治疗)、给药途径(静脉、皮下注射、局部给药)提供策略性建议;
协助脂质/LNP成分选择(如考虑可电离脂质类型对PK、生物分布的影响),以最大化疗效、最小化脱靶;
与客户合作开展生物分布)、蛋白表达、毒性等早期功效和安全性评价。
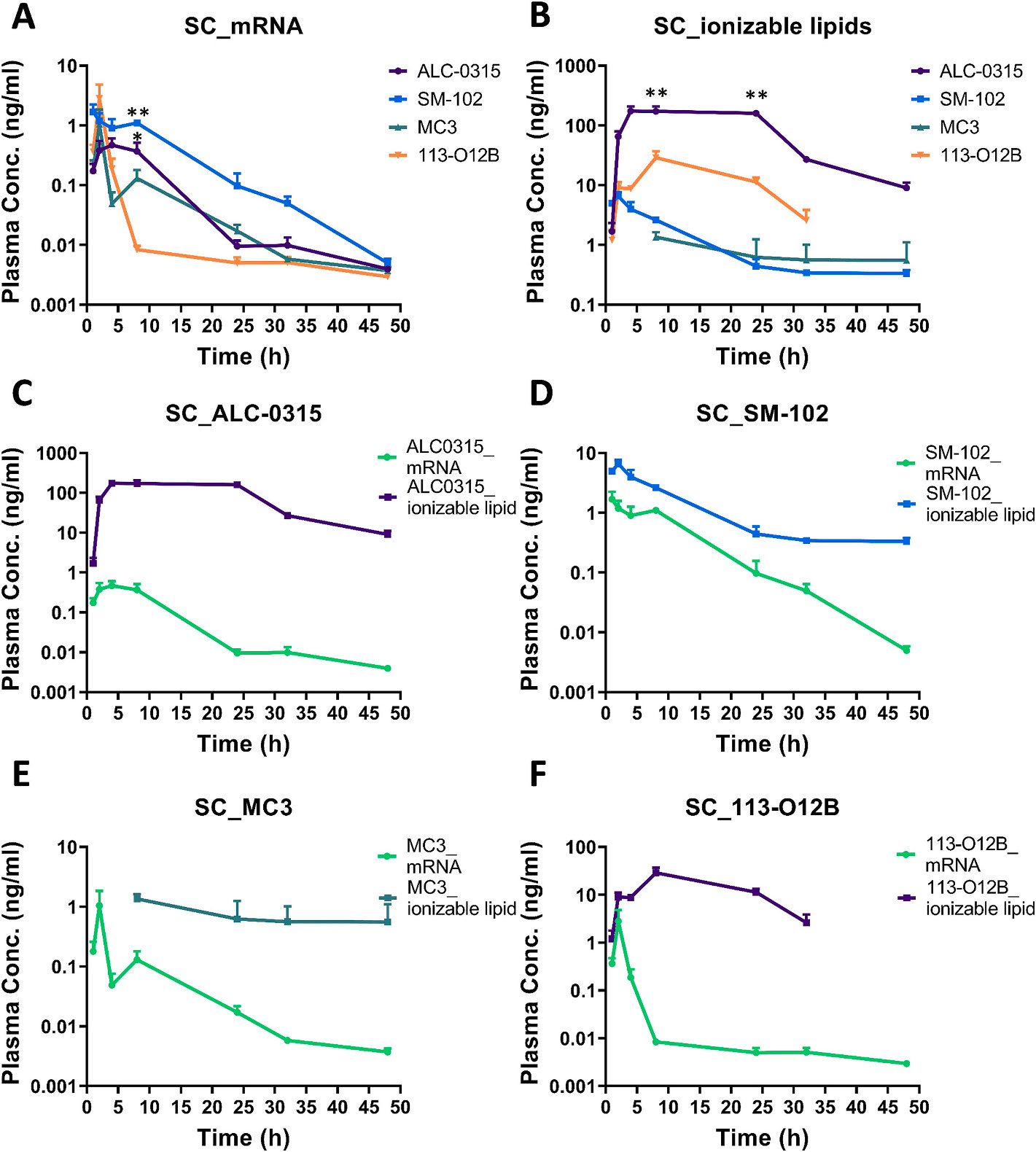
文献引用:“Impact of ionizable lipid type on the pharmacokinetics and biodistribution of mRNA-lipid nanoparticles after intravenous and subcutaneous injection”
摘要:可电离脂质在mRNA-脂质纳米颗粒配方中起着关键作用,有助于mRNA的封装,促进细胞摄取,并增强mRNA-LNP的内体逃逸。尽管它们在 mRNA传递中至关重要,但可电离脂质对mRNA-LNP 在体内药代动力学(PK)和生物分布的具体影响仍鲜为人知。本研究考察了 SM-102、ALC-0315、DLin-MC3-DMA可电离脂质在 mRNA-LNP 配方中对小鼠皮下(SC)和静脉(IV)给药后脂质和 mRNA 的血浆 PK 以及表达蛋白的生物分布的影响。我们的研究结果表明,改变可电离脂质会显著影响mRNA和LNP脂质的血浆药代动力学以及表达蛋白的组织生物分布情况。SM-102 LNP配方在血浆中对 mRNA 的保护作用更佳,生物利用度最高,皮下注射后约为其他脂质的三倍。相反,ALC-0315 LNP导致脂质暴露时间延长,但血浆中mRNA浓度低于 SM-102 LNP,无论采用何种给药途径。尽管存在这些药代动力学差异,但 SM-102和ALC-0315 LNP在两种给药途径下均实现了相当的整体组织蛋白表达,我们的数据表明这可能是因为在早期时间点,LNP中的mRNA在血浆中更易于表达。MC3可电离脂质表现出最长的终末半衰期,两种给药方式后均伴有 mRNA表达延迟。静脉注射后,所有配方的蛋白表达主要在肝脏中观察到,且生物分布模式随时间变化。相比之下,皮下注射导致更高局部表达,尤其是在皮肤和注射侧淋巴结中。这些发现为离子化脂质对mRNA-LNP药代动力学和生物分布的影响提供了宝贵的见解,表明离子化脂质的选择显著影响mRNA-LNP的药代动力学和表达蛋白的生物分布,并且可以进行策略性调整,以优化 mRNA-LNP制剂在特定适应症中的药代动力学和生物分布,从而提供更有效的治疗,同时减少脱靶效应。
中新康明LNP-CDMO的核心优势
一体化平台优势:从配方设计、工艺开发、中试、分析、注册支持到大规模生产,服务覆盖核酸‑LNP全生命周期。这种端到端服务极大降低了客户整合不同供应商、协调管理的复杂性。
丰富脂质技术积累:作为在脂质体、水凝胶、胶束、微球等纳米载体领域深耕多年的高科技企业,中新康明具有广泛的脂质合成和表征经验。其自主合成脂质能力也为定制化可电离脂质提供了可能。
强大的分析与质量控制能力:配备先进表征技术(DLS,TEM,NTA等)和质量体系,保证每批LNP的性能和一致性。
合规与申报经验:具备IND注册所需的CMC文档编写、稳定性研究、无菌、内毒素检测等能力,可为临床和商业化客户提供可靠保障。
随着科学界对可电离脂质种类(如SM-102、ALC-0315、MC3等)对LNP性能(血浆稳定性、表达时间、生物分布等)的理解不断深入,研发团队在配方设计阶段就面临更高要求。中新康明通过其系统化、一体化LNP-CDMO平台,为客户提供从基础配方优化到临床商业化生产的全链条服务,使得客户能够更快、更安全、更灵活地推出基于mRNA或其他核酸的创新疗法。
在未来,中新康明计划进一步扩展其脂质合成能力(包括新型可电离脂质)、加大中试放大型产能投入,并深化与国内外生物医药公司合作。通过不断提升其技术能力与服务灵活性,中新康明致力于成为全球领先的核酸-LNP-CDMO合作伙伴,推动更多基因疗法和RNA疗法的临床落地,实现“创新无界,应用无限”的愿景。
 返回
返回