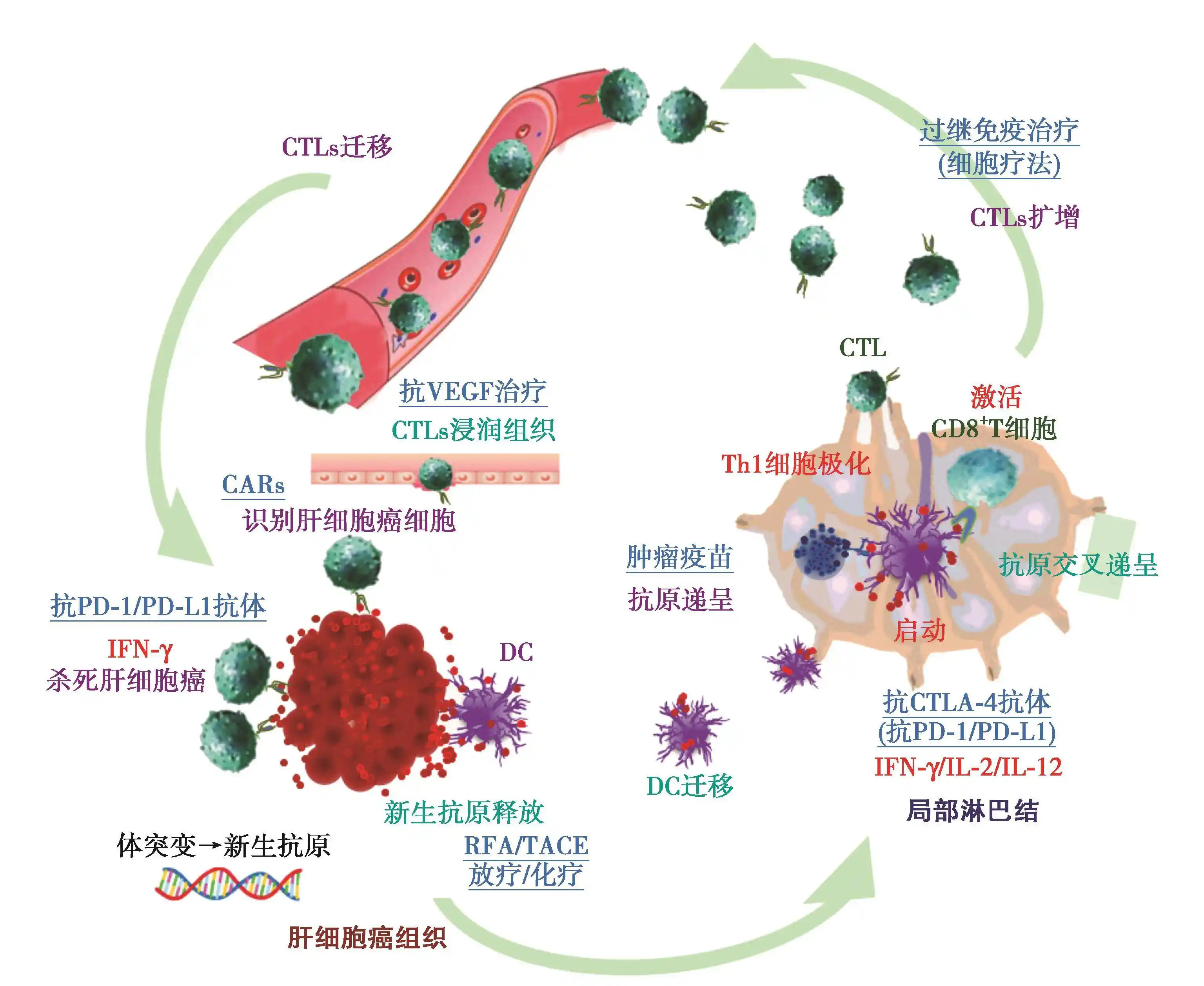
随着肿瘤免疫治疗的迅猛发展,溶瘤腺病毒(OncolyticAdenovirus,OAd)作为一种能够在肿瘤细胞中选择性复制并裂解肿瘤的生物制剂,正成为抗肿瘤治疗的重要方向。OAd不仅可通过直接裂解作用杀伤肿瘤细胞,还能通过释放肿瘤相关抗原、激活机体免疫系统,诱导强效的系统性抗肿瘤反应。然而,溶瘤病毒在体内递送过程中仍面临一系列挑战,如中和抗体清除、系统毒性、肿瘤穿透效率低以及靶向性不足等。这些问题严重制约了OAd在临床中的疗效转化。
为提高病毒递送效率与肿瘤靶向性,研究者开始探索利用脂质体包封或复合技术来改善溶瘤病毒的生物分布与免疫环境调控。其中,以DP7-C/DOTAP脂质体复合体系为代表的新型递送载体方案,在提升OAd抗肿瘤活性方面展现出显著潜力。
一、DP7-C/DOTAP脂质体复合体系的科学基础与抗肿瘤机制
DP7-C是一种源自抗菌肽(HostDefensePeptide)的衍生物,具有优异的免疫调节能力,可通过激活树突状细胞(DC)和巨噬细胞、促进炎性细胞因子释放来增强肿瘤免疫反应。而DOTAP(1,2-dioleoyl-3-trimethylammonium-propane)是一种经典的阳离子脂质,常用于mRNA疫苗、siRNA及DNA递送,其带正电的分子结构能与带负电的生物分子或病毒衣壳相互作用,形成稳定的纳米复合体。
DP7-C与DOTAP的协同作用可实现“双重增强”机制:
物理保护与高效包封:DOTAP脂质体能够有效包裹溶瘤腺病毒,避免其在血液循环中被补体系统或中和抗体快速清除,提高病毒到达肿瘤部位的几率。
免疫激活与微环境重塑:DP7-C可诱导先天免疫应答,通过上调MHC-Ⅱ、CD86等共刺激分子,促进抗原递呈和T细胞激活,从而显著增强病毒的免疫协同效应。
研究表明,DP7-C/DOTAP脂质体可显著提升OAd在肿瘤组织中的感染效率和裂解活性,同时激发更强的T细胞介导免疫反应,实现“病毒直接溶瘤+免疫系统清除”的双重抗肿瘤模式。这一复合体系在多种动物模型中均展现出优于单独病毒或普通阳离子脂质的治疗效果,具有良好的临床前应用前景。
二、处方优化与工艺控制的关键环节
DP7-C/DOTAP脂质体的稳定性与性能高度依赖于处方比例、粒径控制及混合参数。通常,DOTAP与DP7-C需在特定摩尔比下形成电中性或微正电荷的复合结构,以兼顾病毒结合效率与体内安全性。脂质体粒径一般控制在100–200nm范围内,以保证良好的肿瘤渗透性与细胞摄取能力。
在制备工艺上,微流控混合技术被广泛用于获得高重现性与规模化生产能力。混合速率、溶剂比例及温度控制均会影响脂质体的包封率和病毒感染力。此外,制剂的冻干保护剂选择与复溶稳定性验证也是工艺开发中的关键节点,需要系统的处方筛选与工艺验证支持。
三、中新康明助力从实验室研究到产业化转化
中新康明(SinocomBiotech)作为国内领先的脂质原料与递送平台解决方案提供商,专注于核酸药物、脂质体及LNP系统的原料开发与产业化支持,能够为客户提供从公斤级原料供应到制剂处方优化、工艺开发及中试放大的全流程服务。
公斤级高纯度原料供应
中新康明拥有成熟的脂质合成与纯化体系,可稳定提供公斤级高纯度DOTAP及定制化DP7-C原料,满足GLP毒理实验、临床前研究及早期临床项目的用量需求。所有原料均经过HPLC、LC-MS、NMR等多维分析验证,纯度≥98%,并可根据客户需求配套COA、TDS及注册申报所需DMF文件支持。
处方优化与配方开发
公司配备先进的微流控制备与分析平台,能够根据客户项目需求开展DP7-C/DOTAP比例优化、粒径调控、电位调节、冻干保护剂筛选等实验工作。同时,可根据不同病毒类型(腺病毒、HSV、VV等)定制脂质配方,最大化递送效率与稳定性。
工艺开发与中试放大
针对客户的制剂生产需求,中新康明可协助完成从实验室工艺验证到中试放大的全流程开发,包括溶剂体系优化、混合设备选型、过滤灭菌、冻干工艺以及批次一致性评估。公司拥有符合GMP要求的中试车间及质量管理体系,确保批次间稳定、放大可重现。
技术与法规支持
中新康明在脂质体与LNP领域积累了丰富的申报经验,可为药企提供CMC文件支持、质量标准制定及分析方法转移指导,帮助客户缩短从研发到IND申报的周期。
四、应用前景与合作价值
DP7-C/DOTAP脂质体复合体系在增强溶瘤腺病毒疗效方面展现出独特优势,不仅能够提升病毒的体内稳定性与感染力,还能显著改善肿瘤免疫微环境,为OAd疗法的临床转化提供了新的突破口。随着病毒免疫治疗、溶瘤病毒载体疫苗及肿瘤免疫联合疗法的持续发展,对高纯度脂质原料与稳定生产工艺的需求将持续增长。
中新康明凭借在脂质研发、工艺优化与放大生产方面的深厚技术积累,正与多家国内外制药企业和科研机构合作,共同推进基于DP7-C/DOTAP脂质体的创新抗肿瘤疗法开发。公司致力于以稳定的原料供应、完善的技术支持及合规的质量体系,助力合作伙伴加速临床转化进程,推动溶瘤病毒疗法迈向更高效、更安全的应用新阶段。
五、文献引用
“DP7-C/DOTAP脂质体增强溶瘤腺病毒抗肿瘤效用的研究”
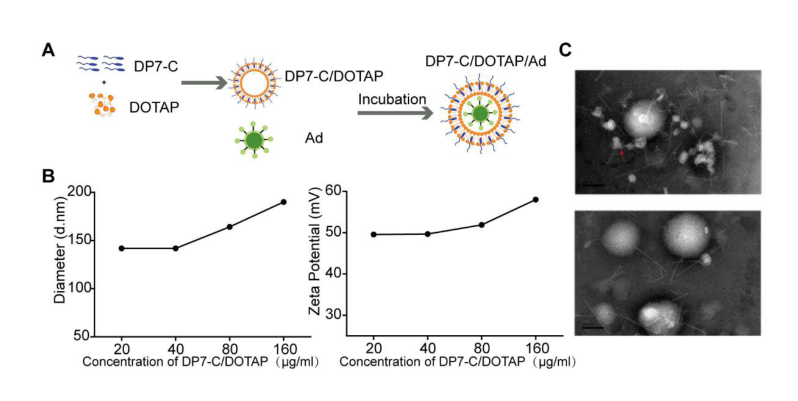
关键词:溶瘤腺病毒;DP7-C/DOTAP阳离子脂质体;卵巢癌;
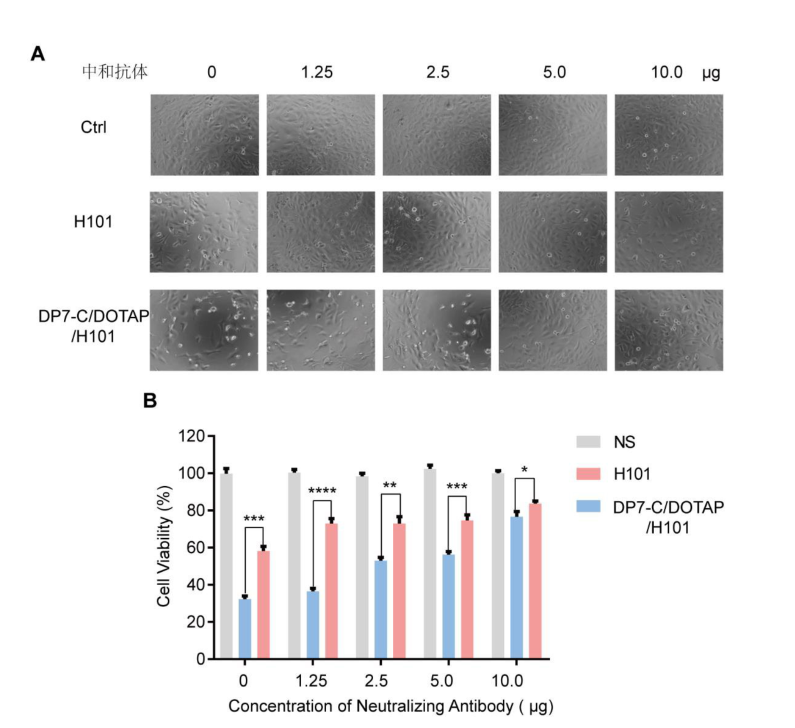
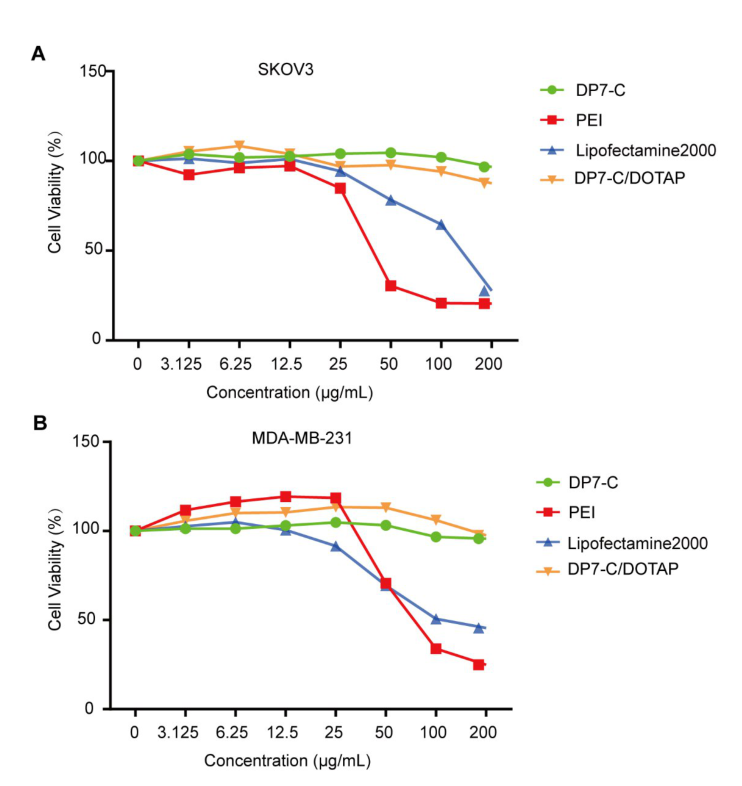
文献节选:利用DP7-C/DOTAP脂质体作为腺病毒运载工具,一方面通过DP7-C/DOTAP脂质体增强溶瘤腺病毒转染CAR受体低表达肿瘤细胞,克服溶瘤腺病毒在转染细胞时受到的CAR限制,提高转染效率;另一方面通过用DP7-C/DOTAP脂质体包裹溶瘤腺病毒,保护溶瘤腺病毒不被中和抗体清除。验证两方面增强溶瘤腺病毒的“溶瘤”作用。方法采用薄膜分散法制备DP7-C修饰的DOTAP脂质体(DP7-C/DOTAP),将腺病毒(Ad)与DP7-C/DOTAP脂质体在体外孵育形成DP7-C/DOTAP/Ad复合物。对DP7-C/DOTAP/Ad复合物的粒径、电位和形态学进行表征。然后在体外检测DP7-C/DOTAP/Ad复合物转染CAR受体低表达肿瘤细胞的效率及抵抗腺病毒中和抗体的功效。最后在小鼠中验证DP7-C/DOTAP脂质体促进溶瘤腺病毒H101的抗肿瘤效果。结果DP7-C/DOTAP脂质体其粒径分布在140~200nm,电位为48~58mV,透射电镜结果显示DP7-C/DOTAP/Ad复合物制备成功。与Ad相比,DP7-C/DOTAP/Ad复合物可显著提高低表达CAR受体卵巢癌细胞SKOV3的转染效率,同时DP7-C/DOTAP脂质体可以起到保护腺病毒不被中和抗体识别和清除的作用。在SKOV3卵巢癌皮下移植瘤模型中,单独H101组抑瘤率为23.90%,H101/DP7-C/DOTAP组抑瘤率为54.81%,可更好地抑制肿瘤生长(P<0.05)。结论DP7-C/DOTAP脂质体包裹腺病毒可增强腺病毒的转染效率和杀伤效果。DP7-C/DOTAP脂质体可有效促进腺病毒转染CAR低表达细胞。DP7-C/DOTAP脂质体可以对腺病毒起到良好的保护效果,不被抗腺病毒中和抗体中和。在动物实验中初步证明采用DP7-C/DOTAP脂质体能够增强溶瘤病毒的抗肿瘤效用。
六、结语
DP7-C/DOTAP脂质体通过免疫调节与病毒递送的协同机制,为溶瘤腺病毒抗肿瘤疗法注入了新的活力。中新康明将继续以公斤级脂质供应能力、系统的处方优化服务及中试放大平台,助力全球合作伙伴在病毒疗法与肿瘤免疫研究领域取得更大突破,推动创新药物研发加速落地。
 返回
返回