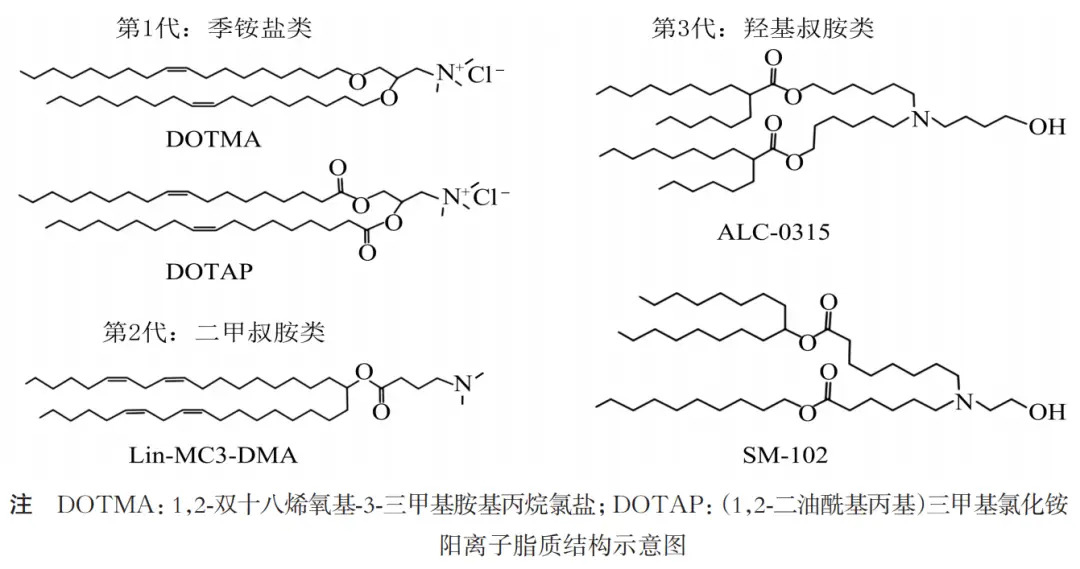
在核酸药物与mRNA疫苗快速发展的今天,脂质纳米颗粒(LNP)已成为最为核心的体内递送平台。其中,DLin-MC3-DMA(简称MC3)是最具代表性的可电离阳离子脂质,被广泛认为是“金标准”载体。作为首个被成功转化并应用于上市核酸药物Onpattro®(patisiran)的关键辅料,MC3的出现奠定了可电离脂质在药物递送中的基础地位。
中新康明凭借先进的合成工艺与质量管理体系,能够提供公斤级大包装的DLin-MC3-DMA,从实验室研究到临床转化再到产业化供应,助力合作伙伴在核酸药物与疫苗开发中取得突破。
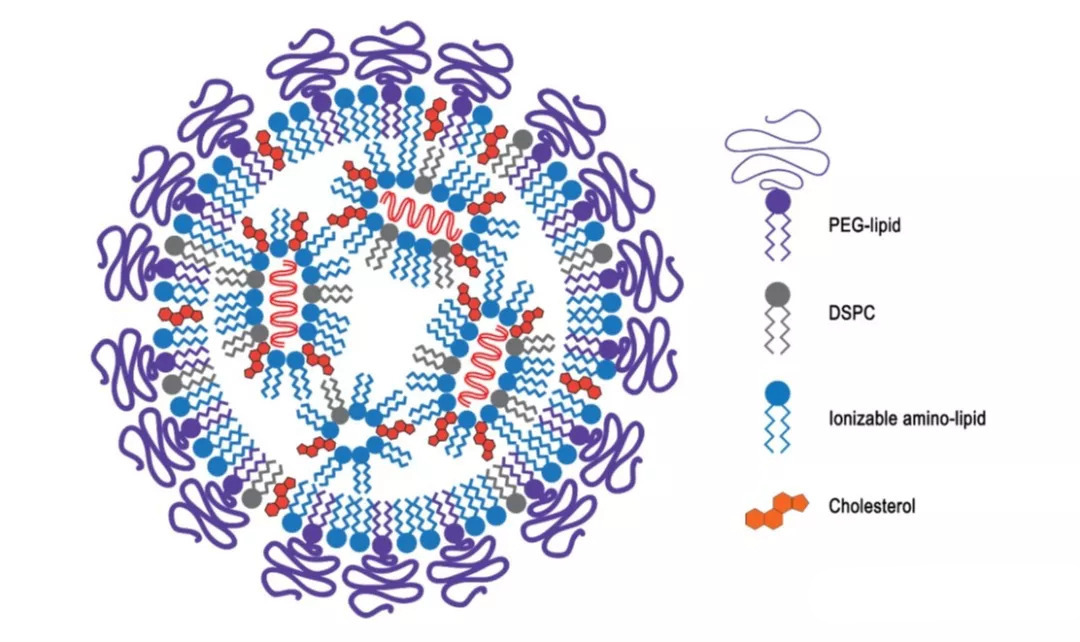
一、DLin-MC3-DMA的核心优势
理想的pKa,精准的内体释放机制
DLin-MC3-DMA的表观pKa大约在6.2–6.5之间,这一数值恰好符合高效递送的“窗口”。在血液生理pH条件下,MC3分子保持接近中性,避免非特异性毒性与免疫激活;而进入酸性内体后,MC3会被质子化并带正电荷,促使其与内体膜融合破裂,从而实现高效的核酸释放。这一特性是MC3高效递送能力的分子基础。
极低的有效剂量
临床前研究表明,MC3递送的siRNA在小鼠与非人灵长类中可实现超低剂量下的高效沉默。例如,在肝脏凝血因子FVII模型中,ED50可低至0.005mg/kg;在人类转甲状腺素蛋白(TTR)模型的非人灵长类实验中,ED50约为0.03mg/kg。这意味着MC3不仅能显著提高给药效率,还能减少潜在毒性风险。
临床成功验证的可靠性
MC3是Onpattro®制剂的关键辅料。作为全球首个获批的siRNA-LNP药物,Onpattro的成功不仅是RNAi研究的重要里程碑,更是MC3临床可行性与安全性的最佳证明。FDA与EMA的审评文件中明确将MC3列为novelexcipient,并对其药代学、安全性及质量控制提出了详尽要求,为后续研发提供了充分参考。
成熟的工艺与监管资料
由于MC3已被广泛研究与应用,相关的合成路线、质量控制指标、药代学特征以及分析方法均有文献与监管资料可循。这为制药企业在进行临床注册时降低了不确定性,也为新药研发提供了成熟的技术参照。
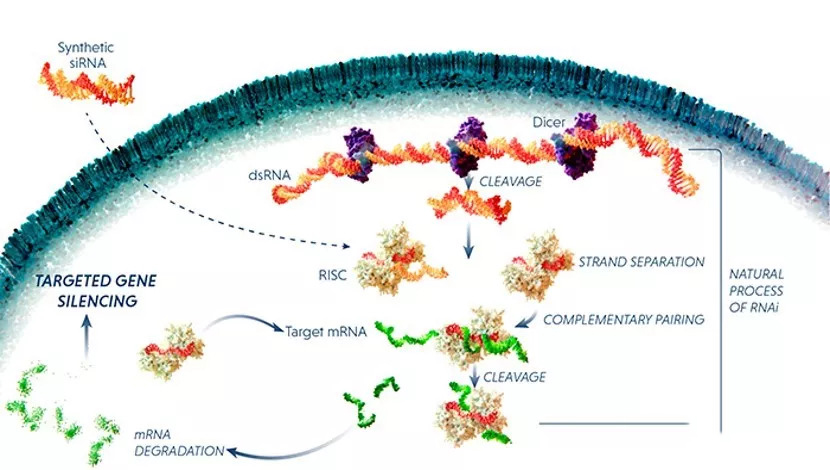
二、从早期筛选到临床转化的研究历程
MC3的研发历程体现了从实验室分子筛选到临床成功转化的完整链条。
早期筛选(学术阶段)
2012年,Jayaraman等人在系统性研究中发现,LNP的递送效率与离子脂质的pKa有直接相关性。他们合成并测试了大量候选脂质,最终筛选出MC3,显示出远超前代脂质(如DLin-KC2-DMA)的效率。这项研究奠定了MC3成为临床候选的科学基础。
临床前验证(动物实验)
MC3-LNP在啮齿类和非人灵长类动物实验中表现出极高的沉默效率和良好的安全性。例如,在肝脏靶向实验中,MC3-LNP可实现超过90%的目标基因沉默,同时保持低剂量和低毒性。
临床应用(Onpattro®的诞生)
Alnylam采用MC3-LNP将siRNA药物patisiran成功转化为商品化药物,并于2018年获FDA与EMA批准。审评资料中详细记录了MC3的工艺、药代、残留分析及稳定性研究,进一步巩固了MC3的产业化地位。
后续发展(对比与优化)
尽管ALC-0315、SM-102等新型可电离脂质在mRNA疫苗中得到应用,但MC3仍作为基准脂质被广泛对照研究。研究者持续探索其与其他脂质在免疫原性、分布特性与降解途径上的差异,为优化配方提供了思路。
三、工业放大与质量控制要点
配方组成经典且稳定
Onpattro的典型处方采用MC3:DSPC:Cholesterol:PEG-lipid=50:10:38.5:1.5(mol%)。这一比例已成为LNP配方的重要参考框架,具有良好的重现性与可放大性。
质量控制标准明确
MC3需满足高纯度(≥98%)、低残留溶剂、明确的异构体控制及稳定性要求。同时,需要建立完整的分析方法(HPLC、LC-MS、NMR等),以保证批次间一致性。
工艺放大注意事项
从克级到公斤级放大过程中,微流控混合参数、溶剂去除、无菌过滤及冻存条件均为关键节点。任何偏差都会直接影响LNP的粒径分布、包封效率与稳定性。
四、中新康明的公斤级生产与服务优势
作为国内领先的脂质原料与递送平台供应商,中新康明致力于为全球客户提供从研发到产业化的全链条支持。
公斤级大包装供应能力
我们能够稳定提供公斤级批次生产的DLin-MC3-DMA,满足临床前大动物实验、毒理学研究以及临床I/II期项目对大规模原料的需求。
严格的质量管理
公司建立了符合国际标准的质量控制体系,提供纯度、含量、水分、残留溶剂、重金属、稳定性等全套检测报告,并可根据客户需求定制COA与注册文件所需资料。
工艺与技术支持
除了原料供应,我们还为客户提供溶解性建议、储存运输方案、微流控工艺参数参考以及关键质量属性(CQAs)识别,协助合作伙伴缩短从研发到申报的周期。
定制化服务
针对不同客户需求,我们可提供工艺开发、放大试验及与CDMO的接口支持,帮助客户解决在LNP制备和产业化过程中可能遇到的难题。
五、应用前景与合作价值
siRNA药物:MC3-LNP在肝脏靶向递送中仍然是效率最高的载体之一,尤其适合开发针对罕见病或肝脏疾病的核酸疗法。
mRNA疫苗与治疗药物:尽管新型可电离脂质层出不穷,但MC3依旧是研究基准脂质,在对照实验、处方开发及方法学优化中不可或缺。
临床前研究与毒理学评价:公斤级原料保障了大规模动物实验与毒理学评估的顺利开展,减少因原料短缺导致的研发风险。
六、参考文献:
“Pharmacokinetics of Patisiran, the First Approved RNA Interference Therapy in Patients With Hereditary Transthyretin-Mediated Amyloidosis”
作者:X Zhang、V Goel、GJ Robbie
关键词:amyloidosis;lipid nanoparticle;patisiran;pharmacokinetics (PK);RNAi therapeutic;small interfering ribonucleic acid (siRNA)
DOI:10.1002/jcph.1553
摘要:
Hereditary transthyretin-mediated (hATTR) amyloidosis is a rare, inherited, progressively debilitating, and often fatal disease caused by deposition of mutated transthyretin (TTR) protein. Patisiran is an RNA interference therapeutic comprising a novel small interfering ribonucleic acid (ALN-18328) formulated with 2 novel lipid excipients, DLin-MC3-DMA and PEG2000-C-DMG, in a lipid nanoparticle targeted to inhibit hepatic TTR synthesis. Here we report the pharmacokinetics (PK) of ALN-18328, DLin-MC3-DMA, and PEG2000-C-DMG from a phase 2 multiple-ascending-dose study and its open-label extension (OLE) in patients with hATTR amyloidosis. Twenty-nine patients received 2 intravenous infusions of patisiran of 0.01, 0.05, 0.15, or 0.3mg/kg at 3- or 4-week intervals; of these, 27 patients received 0.3mg/kg once every 3 weeks over 24months in the OLE study. Plasma PK profiles of ALN-18328 and DLin-MC3-DMA exhibited 2 phases, the first characterized by a short distribution half-life and the second by a minor peak and relatively long terminal elimination half-life. PK exposures to 3 analytes increased proportionally across the dose range of 0.01 to 0.3mg/kg. For ALN-18328, mean terminal elimination half-life was 3.2days, mean total clearance was 3.0mL/h/kg, and urinary excretion was negligible. All 3 analytes exhibited stable PK profiles with chronic dosing over 2 years. The 2- to 3-fold plasma accumulation (AUCτ) of ALN-18328 at steady state is attributable to the association of ALN-18328 with the cationic lipid DLin-MC3-DMA. There was no appreciable accumulation of PEG2000-C-DMG.
七、结语
DLin-MC3-DMA以其独特的理化性质、高效的递送能力以及在Onpattro中的成功应用,成为可电离脂质领域的经典代表。从早期学术筛选到临床成功转化,MC3已被充分验证。面对日益增长的核酸药物与mRNA疫苗市场需求,稳定可靠的原料供应是研发成功的关键。
中新康明凭借公斤级大包装生产能力、严格的质量管理体系和完善的技术支持,愿与全球合作伙伴携手,共同推动核酸药物与疫苗研发迈向新的高度。
 返回
返回