在新冠大流行背景下,mRNA疫苗凭借其快速研发、高效免疫应答和灵活平台优势,成为全球疫情防控的关键技术。中新康明提供脂质体、LNP纳米粒、水凝胶、微球等主流递送系统的全流程开发服务。其中,脂质纳米粒(Lipid Nanoparticle, LNP)作为mRNA的核心递送系统,其配方设计直接决定了疫苗的稳定性、转染效率、免疫原性及安全性。中新康明依托自主脂质库与成熟工艺平台,专注于针对SARS-CoV-2抗原编码mRNA的LNP脂质体配方研究,提供从分子设计到动物验证的一站式解决方案。
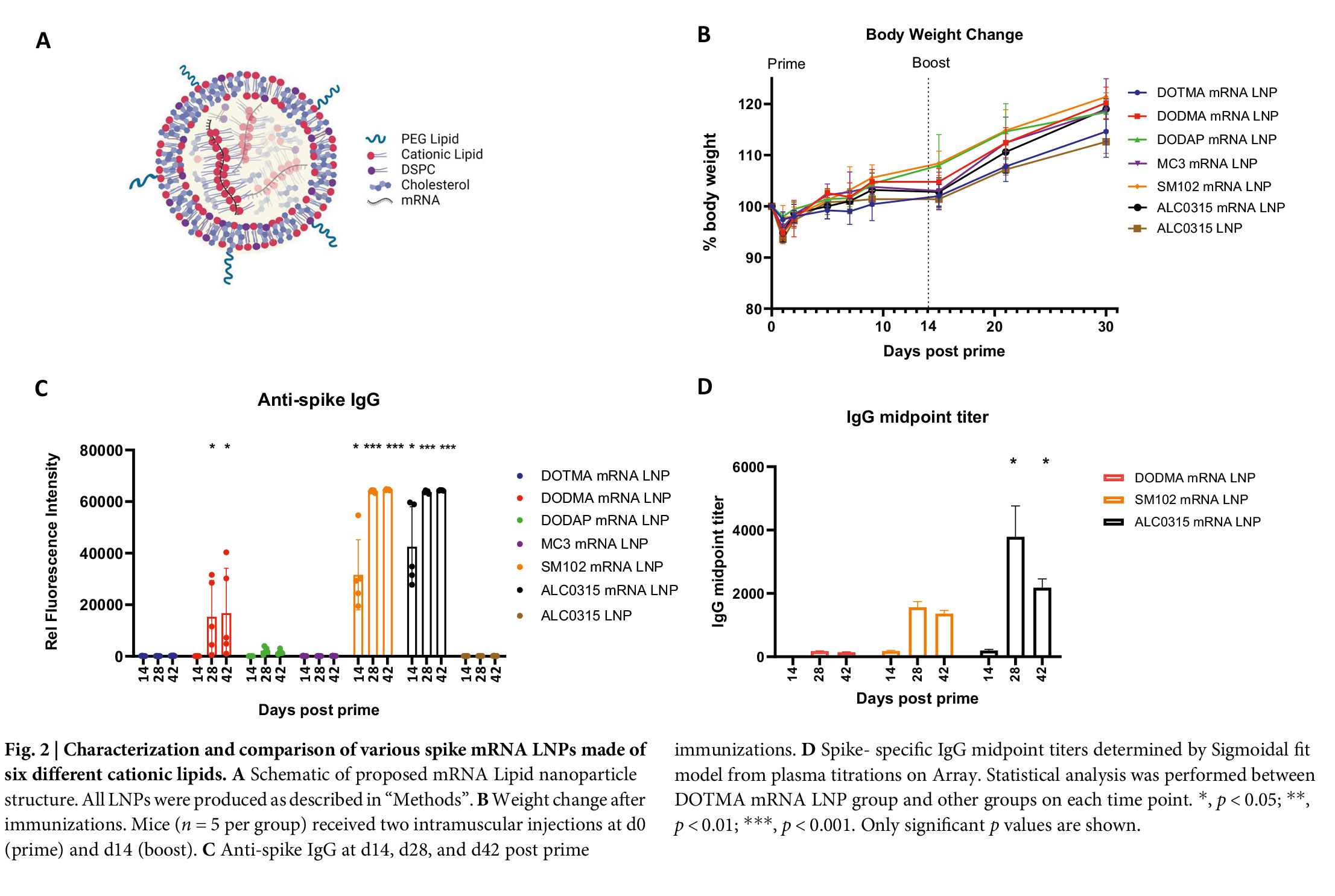
一、中新康明针对COVID-19 mRNA疫苗的LNP配方的全流程研发服务包括:
一、LNP配方定制化设计
1. 脂质组分理性筛选
基于已验证有效的新冠mRNA疫苗平台,我们系统优化以下四类关键脂质:
可电离阳离子脂质:如SM-102类似物或新型专利脂质,确保在酸性内体中带正电以促进内体逃逸,而在生理pH下呈中性以降低毒性。
辅助磷脂:优选DSPC(1,2-distearoyl-sn-glycero-3-phosphocholine),增强膜结构稳定性并支持融合过程。
胆固醇(Cholesterol):调节膜流动性与刚性,提升LNP在血清中的循环稳定性。
PEG化脂质(PEG-Lipid):如DMG-PEG2000或ALC-0159类似物,控制粒径均一性、延长体内半衰期,并减少非特异性免疫清除。
注:所有脂质均符合药用级标准,部分为中新康明自研专利脂质,具备更优的包封率与低炎症反应特性。
2. 配方参数精准调控
针对新冠mRNA疫苗的特殊需求,重点优化:
mRNA负载量:通常维持在10–20 μg/mg脂质,平衡表达效率与制剂稳定性;
粒径控制:目标80–120 nm(PDI < 0.15),确保高效淋巴结引流与细胞摄取;
Zeta电位:接近中性(-5至+5 mV),减少非特异性吸附与聚集;
包封率:>95%,保障mRNA免受RNase降解。
二、LNP制备与工艺开发
采用微流控混合技术(Microfluidics)实现高重现性LNP组装,通过精确控制水相(含mRNA)与有机相(含脂质)的流速比、总流量及混合温度,获得均一稳定的纳米颗粒。
小试阶段:1–10 mL规模,用于处方初筛与体外验证;
中试放大:100 mL–1 L规模,完成工艺稳健性研究;
非GMP衔接:提供符合FDA/EMA/NMPA要求的CMC资料包,支持IND申报所需的工艺验证与无菌灌装方案。
三、全面理化表征与稳定性评估
对每一批次新冠mRNA-LNP进行严格质量控制:
粒径与PDI:动态光散射(DLS)测定;
Zeta电位:激光多普勒电泳法;
mRNA包封率:RiboGreen荧光法结合超滤分离;
mRNA完整性:毛细管电泳(CE)或琼脂糖凝胶电泳;
储存稳定性:在-70℃、-20℃及4℃条件下考察3–6个月,监测粒径漂移、包封率下降及mRNA降解情况。
特别提示:针对冻干需求,我们已开发稳定型冻干保护配方,实现常温运输潜力。
四、体外与体内生物学功能验证
1. 体外验证
转染效率:在HEK293T、DC2.4树突状细胞等模型中检测Spike蛋白表达(Western Blot/流式细胞术);
免疫激活能力:ELISA检测IL-6、IFN-α等细胞因子释放,评估佐剂效应;
细胞毒性:CCK-8/MTT法确认LNP生物相容性。
2. 体内验证(小鼠模型)
免疫原性评价:单次或加强免疫后,检测血清中抗Spike IgG滴度(ELISA)、中和抗体水平(假病毒/活病毒中和试验);
Th1/Th2偏向性:通过IgG2a/IgG1比值判断免疫应答类型,避免Th2偏移相关安全性风险;
组织分布与安全性:荧光标记mRNA追踪LNP在肝、脾、淋巴结等器官的富集情况;监测体重、ALT/AST、组织病理学变化。
五、定制化拓展:应对变异株与新策略
特殊靶向需求:可通过配体修饰实现肝外靶向(如肿瘤、肺、脾等)。
适应症导向设计:针对传染病疫苗、肿瘤免疫、蛋白替代疗法等场景提供定制化开发方案。
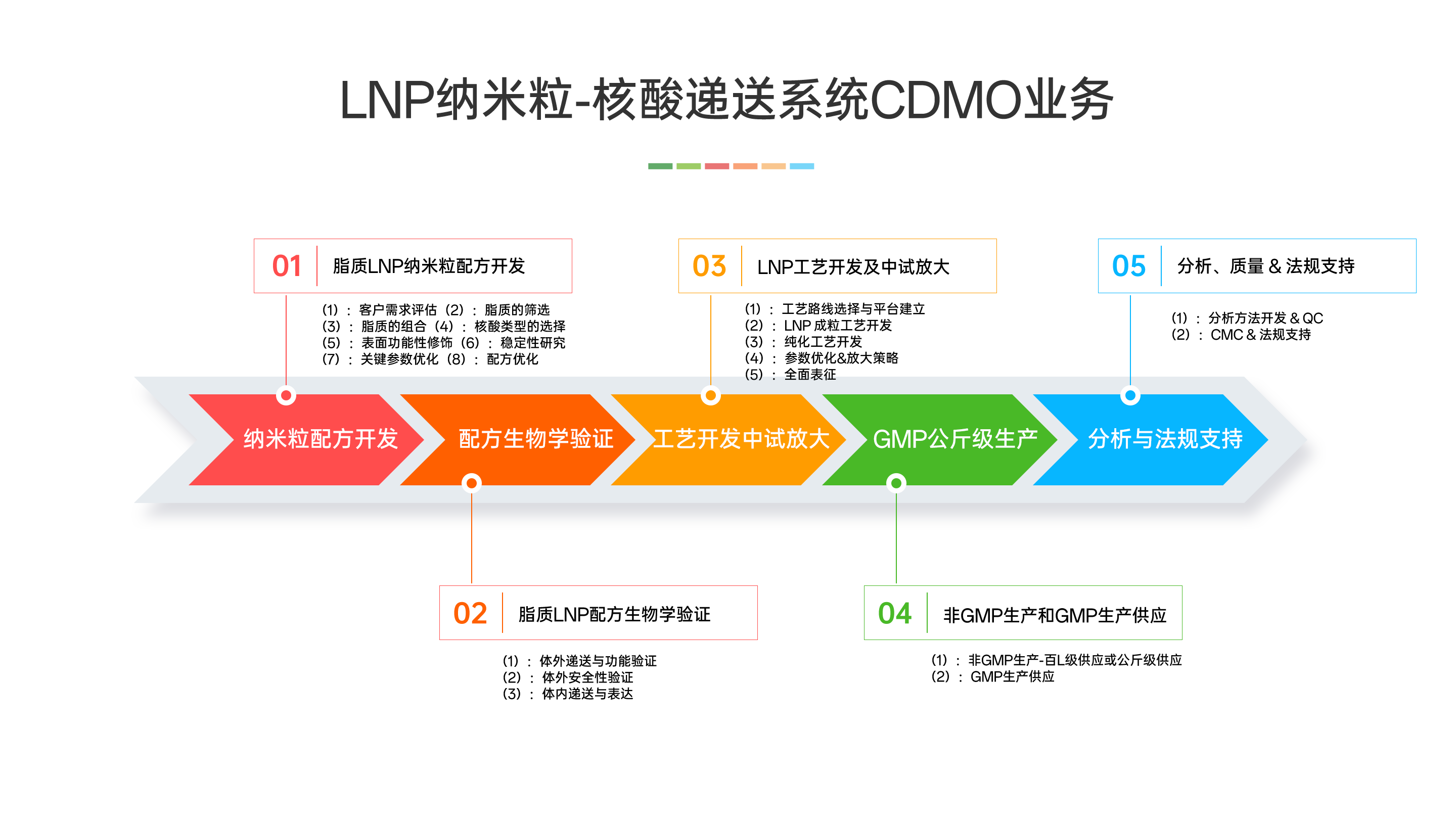
二、中新康明提供覆盖从设计到生产的完整LNP(脂质纳米粒)开发服务:
1.配方开发:基于药物类型与递送需求,定制化筛选脂质组分与比例,支持多种核酸类型(mRNA、siRNA等),并可进行表面功能修饰与稳定性优化。
2.生物学验证:提供体外细胞递送与安全性评估,以及小鼠体内表达、分布与初步毒理研究。
3.工艺开发与放大:建立微流控等制备工艺,完成参数优化与纯化冻干步骤,支持从毫升到百升级的稳定放大与全面表征。
4.非GMP/GMP生产:提供百升级至公斤级非GMP生产,以及符合临床Ⅰ–Ⅲ期要求的GMP无菌灌装与样品供应。
5.分析与法规支持:包括关键质量属性分析方法开发、稳定性研究及CMC与注册申报支持。
三、服务优势与交付保障
中新康明在新冠mRNA-LNP领域已积累数十个成功项目经验,具备:
自主200+种可电离脂质库,支持快速迭代筛选;
微流控平台标准化SOP,批次间RSD < 5%;
GLP/GMP双轨运行能力,无缝衔接临床前到临床阶段;
全链条数据可追溯,满足中美欧监管要求。
四、参考文献和文献引用
参考文献:“Lipid Nanoparticle Development for A Fluvid mRNA Vaccine Targeting Seasonal Influenza and SARS-CoV-2”
摘要翻译:mRNA疫苗代表了传统疫苗的一种有前景的替代方案,这一点在近期的新冠疫情中通过mRNA疫苗的迅速部署得到了证明。在这项工作中,我们对已报道的各种mRNA脂质纳米颗粒(LNP)合成和制备方法进行了调整和优化,评估了一系列可离子化的阳离子脂质,并确定了表现最佳的LNP配方。影响尿嘧啶修饰对mRNA触发免疫反应能力的影响也已得到研究。我们的研究结果表明,未修饰的mRNA和N1-甲基假尿嘧啶修饰的mRNA均能成功诱导小鼠产生抗原特异性抗体反应,而甲氧基尿嘧啶修饰的mRNA则不能。基于这些研究,我们构建了一种二价FluvidmRNA疫苗,由包裹着编码缺失跨膜结构域血凝素或全长天然刺突蛋白的未修饰尿嘧啶mRNA的脂质纳米颗粒组成。该疫苗能刺激强大的T细胞和B细胞免疫反应,并在小鼠模型中对流感病毒或SARS-CoV-2病毒的攻击提供了100%的保护效力,且与单独使用每种单价疫苗相比,其效力未受影响。我们的数据表明,这种多价mRNA疫苗能够通过同时针对多种抗原产生体液和细胞反应来提供对不同病毒的保护。
五、订购流程或订购须知:
交付周期:基础配方研究30–60工作日;含动物验证项目90–180工作日;
样品规格:mRNA-LNP制剂可提供0.1 mg至100 mg mRNA剂量梯度;
运输条件:全程-70℃或-20℃干冰冷链,附温控记录与COA报告;
保密与知识产权:客户拥有全部数据与知识产权,签署NDA保障技术安全。

 返回
返回