一、研究背景:从骨折修复到mRNA递送的新机遇
骨折修复是一个涉及炎症反应、成骨细胞分化与矿化的复杂生物过程。对于骨缺损或难愈合患者而言,传统治疗手段效果有限。近年来,mRNA分子治疗作为精准调控组织修复的新途径,逐渐进入骨科研究视野。
在成骨信号通路中,β-连环蛋白(β-catenin)是Wnt/β-catenin信号的关键调控因子,直接参与骨形成与骨重建。通过递送编码β-连环蛋白的mRNA,可在局部诱导短期、高效的成骨信号激活,为骨折修复提供安全可控的分子干预手段。
然而,mRNA易被降解、细胞摄取效率低,因此开发高效、安全的mRNA载体成为实现其治疗潜能的关键。
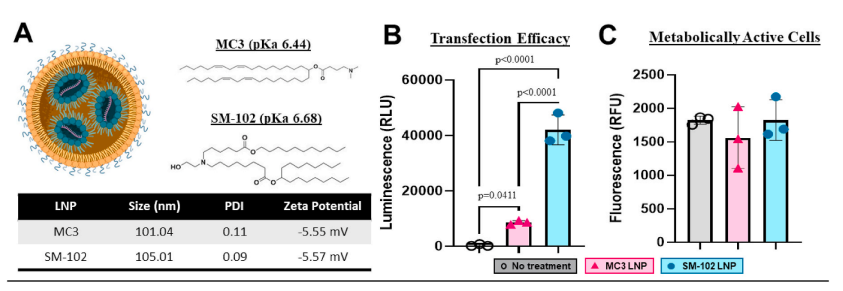
二、SM-102 脂质纳米颗粒——高效递送的核心平台
SM-102是一种代表性的可电离阳离子脂质,具备优异的mRNA包封能力、低免疫原性及良好的生物降解性。该脂质在mRNA疫苗和基因治疗领域已被广泛验证,是构建LNP递送系统的理想材料。
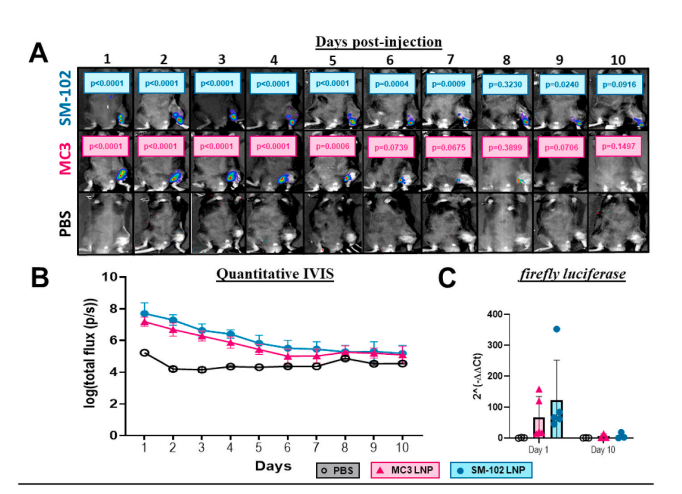
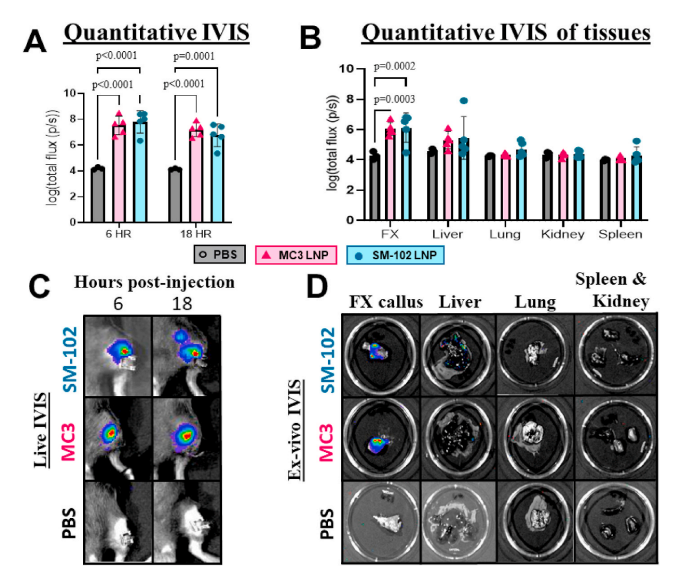
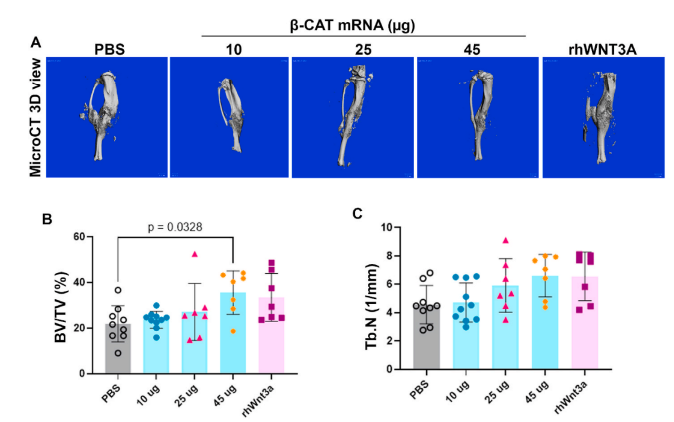
在小鼠胫骨骨折模型研究中,研究团队构建了β-catenin mRNA@SM-102 LNP局部注射体系,显著促进了新骨形成:
✅ 成骨细胞活性显著增强:处理组中ALP活性与骨形成标志基因(Runx2、Col1a1、Ocn)表达均显著上调;
✅ 骨折愈合加速:14天内新骨体积(BV/TV)较对照组提升约60%;
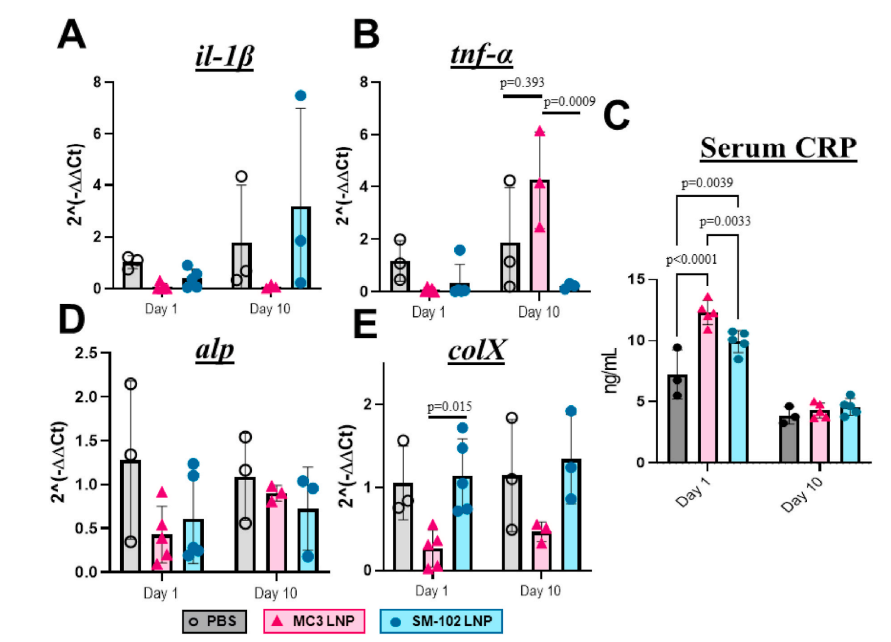
✅ 生物安全性优异:SM-102 LNP在局部组织内降解良好,未见明显炎症反应。
结果表明,SM-102 LNP载体可高效递送β-catenin mRNA,激活局部成骨信号并加速骨修复进程,为mRNA在骨再生医学中的应用提供了可行路径。
三、从实验到应用——中新康明助力mRNA-LNP项目全流程
在mRNA递送体系开发中,从脂质原料到处方优化,再到放大生产与法规注册,每一个环节都决定着最终产品的成功与合规性。
中新康明(Zhongxin Kangming)正是业内为数不多能够提供SM-102脂质原料+工艺开发+检测表征+中试放大+注册支持的一站式服务合作伙伴。
1、公斤级高纯度 SM-102 原料供应
中新康明可稳定提供公斤级生产的高纯度SM-102脂质,产品符合药用级标准,杂质控制严格,具备NMR、HPLC、LC-MS、COA全套质量检测报告。
我们拥有完善的原料追溯体系,保证每批脂质的结构一致性与安全性,为客户提供稳定可放大的LNP基础原料保障。
2、LNP处方优化与工艺开发
依托成熟的脂质递送平台,中新康明可根据不同mRNA类型与靶组织需求,为客户定制SM-102 LNP配方比例优化(SM-102/DSPC/Chol/PEG-lipid)、粒径调控(80–100 nm)、封装率提升(>95%)及体系稳定性验证。
我们支持从小试开发到中试验证的全流程技术转化,并可提供处方设计、DOE优化、冻干稳定化等系统解决方案。
3、质量检测与综合表征服务
中新康明配备完善的检测能力,涵盖:
粒径分布与Zeta电位分析;
mRNA完整性与包封率测定;
体外转染效率与生物相容性评估;
LNP稳定性与释放曲线研究。
通过系统表征,我们帮助客户快速验证LNP性能,缩短研发周期。
4、中试放大与GMP技术转移
公司具备多条连续流微混工艺线,可实现从克级研发到公斤级中试的平稳放大,所有工艺参数可追溯、可转移,便于客户直接衔接GMP临床生产。
同时,中新康明可协助优化关键工艺参数(如流速、N/P比、pH梯度等),确保LNP产品在放大过程中保持粒径与封装率一致性。
5、注册与法规合规支持
面对mRNA药物的监管要求,中新康明提供注册资料撰写、DMF文件支持、药典标准匹配与NMPA/FDA/EMA法规咨询服务,帮助合作伙伴在临床申报阶段顺利推进。
四、典型应用与未来展望
β-catenin mRNA@SM-102 LNP体系的研究为骨再生基因治疗开辟了新方向。未来,该策略还可拓展至软骨修复、骨质疏松治疗及组织工程等领域。
而在这一创新浪潮中,中新康明正通过脂质创新+工艺平台+法规体系三位一体的综合能力,为全球mRNA药物与递送体系开发提供坚实支持:
从SM-102、ALC-0315、MC3到新型可电离脂质,我们具备全面的脂质产品线;
从处方筛选到中试放大,我们掌握成熟的LNP开发路径;
从质量检测到注册报批,我们提供合规、高效的技术支撑。
引用文献:“β-catenin mRNA encapsulated in SM-102 lipid nanoparticles enhances bone formation in a murine tibia fracture repair model ”
节选:Fractures continue to be a global economic burden as there are currently no osteoanabolic drugs approved to accelerate fracture healing. In this study, we aimed to develop an osteoanabolic therapy which activates the Wnt/β-catenin pathway, a molecular driver of endochondral ossification. We hypothesize that using an mRNAbased therapeutic encoding β-catenin could promote cartilage to bone transformation formation by activating the canonical Wnt signaling pathway in chondrocytes. To optimize a delivery platform built on recent advancements in liposomal technologies, two FDA-approved ionizable phospholipids, DLin-MC3-DMA (MC3) and SM-102, were used to fabricate unique ionizable lipid nanoparticle (LNP) formulations and then tested for transfection efficacy both in vitro and in a murine tibia fracture model. Using firefly luciferase mRNA as a reporter gene to track and quantify transfection, SM-102 LNPs showed enhanced transfection efficacy in vitro and prolonged transfection, minimal fracture interference and no localized inflammatory response in vivo over MC3 LNPs. The generated β-cateninGOF mRNA encapsulated in SM-102 LNPs (SM-102-β-cateninGOF mRNA) showed bioactivity in vitro through upregulation of downstream canonical Wnt genes, axin2 and runx2. When testing SM-102-β-cateninGOF mRNA therapeutic in a murine tibia fracture model, histomorphometric analysis showed increased bone and decreased cartilage composition with the 45 μg concentration at 2 weeks post-fracture. μCT testing confirmed that SM-102-β-cateninGOF mRNA promoted bone formation in vivo, revealing significantly more bone volume over total volume in the 45 μg group. Thus, we generated a novel mRNA-based therapeutic encoding a β-catenin mRNA and optimized an SM-102-based LNP to maximize transfection efficacy with a localized delivery.
五、结语
SM-102作为新一代mRNA递送核心脂质,不仅在疫苗领域取得巨大成功,也正在推动骨科与再生医学进入“基因调控修复”新时代。
中新康明凭借公斤级脂质供应能力、先进的LNP开发平台与专业法规支持团队,正帮助越来越多科研机构与药企将mRNA递送构想转化为可验证的临床候选产品。
未来,我们将继续携手合作伙伴,以高质量SM-102脂质与系统化CDMO服务,助力更多创新疗法从实验室走向临床,实现“从分子到药物”的跨越式加速。
 返回
返回