三阴性乳腺癌(Triple-Negative Breast Cancer, TNBC)是乳腺癌中最具侵袭性和异质性的亚型之一,约占所有乳腺癌的15%–20%。由于缺乏雌激素受体(ER)、孕激素受体(PR)及HER2受体表达,TNBC无法从激素疗法或靶向疗法中获益,临床治疗仍主要依赖化疗与新兴的免疫疗法。然而,药物毒副作用大、靶向效率低、肿瘤复发率高等问题,始终制约着治疗效果的提升。
在此背景下,基于脂质纳米颗粒(LNPs)与脂质体的药物递送系统成为提升TNBC治疗效果的关键方向。其中,二油酰磷脂酰乙醇胺(1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine, DOPE)凭借其独特的生物物理特性,在构建高效递药系统中展现出显著优势。
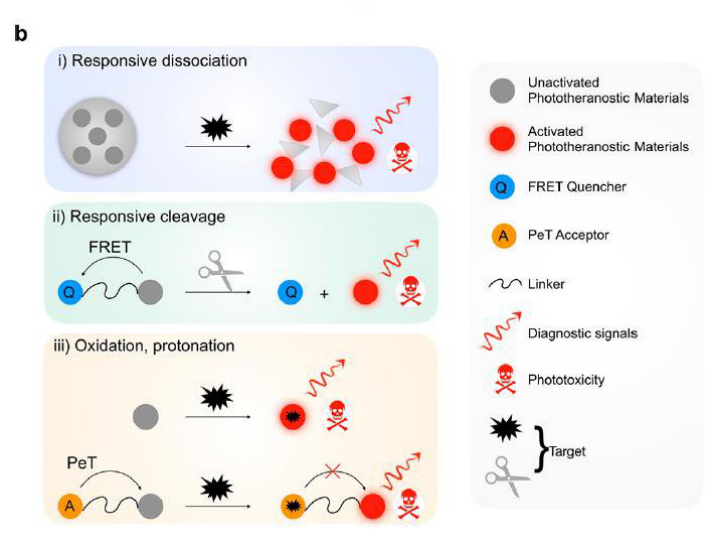
一、DOPE脂质的结构与特性:天然“融合促进者”
DOPE是一种中性辅脂质(helper lipid),广泛用于脂质体、LNP、基因载体等体系中。其分子结构由两个顺式双键的油酸链和带有乙醇胺头基的甘油骨架组成,具备明显的锥形分子结构。这种结构赋予DOPE在膜融合、胞吞释放及靶向药物递送过程中独特的优势:
促进内涵体逃逸(Endosomal Escape)
DOPE在酸性环境下可由层状结构(Lα)转变为六角相(HII),促进载药脂质体与内涵体膜的融合,从而有效释放药物或核酸至细胞质中。对于核酸药物(如siRNA、mRNA)治疗TNBC而言,这是提高递送效率和生物利用度的关键。
增强膜融合与细胞摄取
DOPE具有较高的膜流动性与负曲率,能够显著提升纳米颗粒与细胞膜的相互作用,促进脂质体快速与肿瘤细胞膜融合,提高药物内吞效率。
改善载体稳定性与药物释放特性
通过与其他阳离子脂质(如DOTAP、DC-Chol)或PEG修饰脂质(如DSPE-PEG2000)共配方,DOPE可调节膜流动性与表面电荷,兼顾体系稳定性与药物控释性能,为TNBC提供更持久、可控的治疗效果。
优异的生物相容性与可降解性
由于DOPE属于天然磷脂衍生物,其代谢途径清晰,生物相容性高,不会引发显著的免疫排斥或系统毒性,适合用于临床级脂质制剂开发。
二、DOPE在三阴性乳腺癌中的应用前景
在TNBC研究与临床转化中,DOPE被广泛用于多种载药体系,包括:
1. siRNA与mRNA递送
研究表明,DOPE与可电离阳离子脂质(如DLin-MC3-DMA或ALC-0315)共同构建的LNP,可显著提高核酸药物在TNBC细胞中的递送效率。例如,利用DOPE增强的LNP-siRNA体系,可有效沉默肿瘤转录因子STAT3、c-Myc或PD-L1表达,从而抑制肿瘤生长并提高免疫治疗响应。
2. 化疗药物载体
DOPE在多柔比星、紫杉醇等疏水性药物脂质体中发挥“稳定-释放双调控”作用。其流动性膜结构既可提高药物包封率,又可通过相变行为实现酸敏性释放,增强药物对TNBC细胞的靶向杀伤。
3. 联合免疫治疗平台
近年来,DOPE基脂质体被用于联合递送免疫激活剂(如CpG、R848)与化疗药物,实现“免疫-化疗”协同效应。DOPE的高融合性保证了免疫配体在肿瘤微环境中有效释放,为免疫冷肿瘤转化为“热肿瘤”提供了新的技术路径。
三、中新康明——从原料到产业化的全链路DOPE解决方案
随着mRNA药物、siRNA治疗及靶向脂质体药物的快速发展,市场对高纯度、可规模化生产的DOPE脂质需求急剧增长。
中新康明凭借多年脂质材料研发与CDMO经验,能够为药企、科研机构及创新药公司提供公斤级DOPE生产、载体体系工艺开发及中试放大服务,实现从研发到商业化的无缝衔接。
1. 公斤级高纯度DOPE生产能力
公司采用符合GMP要求的合成与纯化体系,确保DOPE产品在纯度(≥99%)、酸值、水分、过氧化值等关键指标上满足药用标准。
提供不同规格包装(克级—公斤级),满足从实验验证到中试放大的全流程需求。
可定制化脂肪酸链长、饱和度与异构体比例,为特殊配方提供差异化原料。
2. 脂质载体配方与工艺开发
拥有成熟的脂质体与LNP处方优化平台,可基于DOPE搭配其他脂质(如DOTAP、DSPC、DSPE-PEG2000等)进行高效处方筛选。
提供粒径调控、包封率优化、稳定性验证等一体化服务。
具备核酸药物、抗肿瘤药物脂质载体的全流程研发经验,缩短客户项目从概念到临床阶段的时间。
3. 中试放大与产业化转移
中新康明拥有先进的脂质体与LNP中试生产线,支持**从实验室规模(mL级)到中试生产(L—100L级)**的放大验证。
通过质量体系(ISO9001)及过程验证,确保批次间一致性与可追溯性。
提供技术转移与产业化落地支持,为客户搭建符合药品注册要求的生产工艺包。
四、结语:让DOPE助力三阴性乳腺癌精准治疗新时代
DOPE不仅是脂质体的“辅脂质”,更是未来精准递药体系的关键调控分子。
在三阴性乳腺癌等难治性肿瘤治疗中,DOPE通过改善递送效率、促进细胞摄取和内涵体逃逸,为药物递送体系带来了革命性提升。
依托中新康明在脂质合成、载体工艺开发及中试放大方面的系统能力,科研机构与制药企业能够更高效地将创新理念转化为可量产、可申报、可临床的药物产品。

文献引用:“多功能放疗响应性脂质体的构建及其在三阴性乳腺癌治疗中的作用与机制研究”
关键词:放疗响应性脂质体;肿瘤放疗增敏;切伦科夫辐射;三阴性乳腺癌;远隔效应;肿瘤免疫微环境;肿瘤免疫治疗;
专辑:医药卫生科技
专题:肿瘤学
DOI:10.27342/d.cnki.gscdu.2021.008315
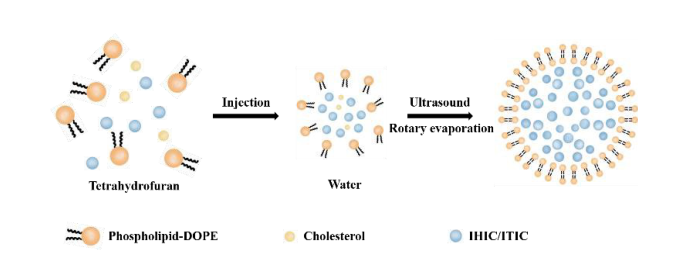
放疗是乳腺癌的主要治疗手段之一,在缓解局部症状、提高肿瘤局部控制率、改善患者生存预后等方面发挥重要作用。但是,作为恶性程度较高、预后较差的乳腺癌亚型,三阴性乳腺癌(雌激素受体、孕激素受体、人表皮生长因子受体-2皆呈阴性表达)对放疗的敏感性相对较差,亟需寻找有效手段提高其放疗疗效。 三阴性乳腺癌细胞生长迅速、代谢水平旺盛,其肿瘤组织内普遍存在乏氧情况,而乏氧会减弱放射线对DNA的损伤,进而导致肿瘤细胞放疗抵抗、放疗疗效下降。因此,改善三阴性乳腺癌组织内的乏氧状况是增强其放疗敏感性、提高放疗疗效的有效途径。另一方面,放疗可促进肿瘤相关抗原(Tumor-associated Antigen,TAA)释放,诱发全身性的抗肿瘤免疫应答,从而引发远隔效应。然而,三阴性乳腺癌肿瘤微环境中大量的免疫抑制性成分往往会削弱放疗对免疫系统的正向调控作用,导致抗肿瘤免疫效应难以维持。因此,在改善三阴性乳腺癌组织乏氧、增强其放疗敏感性的基础上,对其施以有效的免疫刺激、触发全身性的抗肿瘤免疫反应,实现放疗增敏与免疫激活的有效协同,有望显著提高三阴性乳腺癌的放疗疗效。 在本研究中,我们构建了一种新型多功能放疗响应性脂质体HA-CpG/CAT@GE11-PpIX-liposome(GCEXL),通过与放疗联合,实现放疗增敏与免疫激活的有效协同,进而提高三阴性乳腺癌的疗效。首先,我们选取不饱和磷脂分子(2,3-二油酰基-丙基)-三甲基氯化铵((2,3-Dioleyl-propyl)-trimethylamine,DOTAP)和1,2-二油酰-sn-甘油-3-磷酸乙醇胺(1,2-Dioleoyl-sn-glycero-3-phosphoethanolamine,DOPE)构成脂质体的基础骨架,并将EGFR靶向肽GE11作为靶向元件修饰于脂质体表面;随后,将光敏剂PpIX(Protoporphyrin IX,原卟啉)包封于脂质体磷脂双分子层内,把过氧化氢酶(Catalase,CAT)包载于脂质体内水相;最后,将免疫佐剂HA-CpG包裹于脂质体表面完成脂质体GCEXL的构建。在该脂质体载药体系中,GE11可与三阴性乳腺癌细胞上普遍高表达的EGFR特异性结合,介导细胞对脂质体的内吞、促进细胞对脂质体的摄取;PpIX在放疗时吸收切伦科夫辐射(Cherenkov Radiation,CR)生成活性氧(Reactive Oxygen Species,ROS),ROS一方面可以攻击细胞的膜结构及溶酶体诱导细胞死亡,另一方面能够通过破坏脂质体的膜结构使包载于其内的CAT在放疗辐照下响应性释出;随之,CAT分解肿瘤组织中的内源性过氧化氢生成氧气、增强肿瘤放疗敏感性,同时为ROS生成提供底物、促进ROS生成,从而更大程度地杀伤肿瘤细胞、释放更多肿瘤相关抗原;同时HA-CpG可刺激树突状细胞(Dendritic cells,DCs)成熟活化,增强免疫系统对肿瘤相关抗原的识别、处理及呈递,进而触发全身性抗肿瘤免疫反应,实现放疗增敏与免疫激活的有效协同。
 返回
返回