牙龈卟啉单胞菌(Porphyromonas gingivalis,简称P.g.)是引发慢性牙周炎的关键致病菌,被视为“牙周病的主谋”。近年来,大量研究发现P.g.不仅破坏牙周组织、诱发牙槽骨吸收,还可能通过系统炎症反应参与心血管疾病、糖尿病及阿尔茨海默病等的发生。因此,开发安全、高效的抗P.g.策略成为口腔与全身健康领域的热点课题。
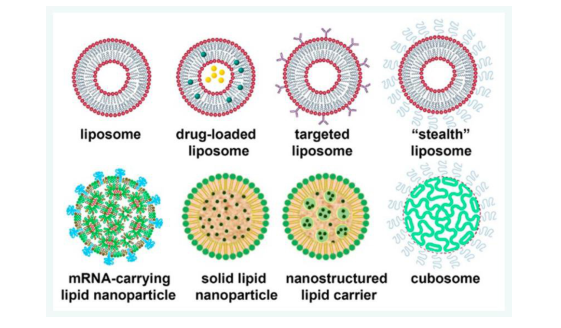
在这一过程中,脂质体作为一种新型药物递送系统,因其良好的生物相容性、靶向性及控释性能,逐渐展现出在抗菌药物递送与感染治疗中的独特潜力。而在脂质体的组成中,二棕榈酰磷脂酰胆碱(DPPC, 1,2-Dipalmitoyl-sn-glycero-3-phosphocholine)凭借其卓越的稳定性与膜特性,成为制备抗菌脂质体的“黄金磷脂”。
一、DPPC脂质在抗牙龈卟啉单胞菌研究中的核心优势
1. 膜稳定性强,构建稳健的抗菌纳米屏障
DPPC属于饱和磷脂,具有较高的相变温度(约41℃),在生理温度下形成有序、致密的脂双层结构。这种结构特征使得以DPPC为主要组分的脂质体膜更加稳定,不易被P.g.分泌的蛋白酶、脂肪酶或外泌体破坏,从而延长药物在口腔环境中的滞留时间,实现更持久的抗菌效果。
2. 良好的生物相容性与低毒性
作为天然来源的磷脂,DPPC广泛存在于人体肺泡表面活性物质与细胞膜中,对口腔上皮细胞具有极佳的生物相容性。相比传统抗菌剂或阳离子聚合物,DPPC不会引起细胞毒性或刺激反应,适用于口腔黏膜这一敏感部位的长期应用。
3. 增强抗菌药物包载与靶向性
DPPC脂质体能高效包封氯己定、甲硝唑、银离子、天然多酚等多种抗P.g.活性分子。通过调节DPPC与胆固醇或带电脂质(如DPPG、DOTAP)的比例,可在保证稳定性的同时优化药物释放速率与靶向性。例如,研究显示DPPC/胆固醇复合脂质体可在牙龈下生物膜中缓释抗菌成分,显著抑制P.g.生长并破坏其生物膜结构。
4. 可与表面活性因子协同抑菌
DPPC不仅可作为药物载体,还能直接影响细菌膜结构。其磷脂酰胆碱头基能与P.g.外膜中的脂多糖相互作用,改变细菌膜的流动性与通透性,增强抗菌药物的入侵能力。结合阳离子脂质或抗菌肽时,DPPC还能进一步促进膜融合与细菌裂解,展现出“多机制协同”抗菌效果。
5. 适用于口腔局部递送系统开发
DPPC基脂质体可被制备为口腔喷雾剂、牙龈凝胶、纳米乳或贴片等多种剂型。其控释特性可实现药物在牙周袋内的持续释放,从而降低用药频次、提高患者依从性,是未来智能抗菌材料与精准口腔治疗的重要方向。
二、中新康明:从脂质原料到应用工艺的一体化解决方案
作为国内领先的脂质原料与递送系统解决方案提供商,中新康明长期专注于高纯度磷脂与脂质体关键原料的研发、生产与应用转化。在DPPC产品与工艺开发方面,中新康明已建立公斤级稳定生产体系,为科研机构与药企客户提供从原料到中试放大的全流程支持。
1. 公斤级高纯度DPPC稳定供应能力
中新康明具备完善的脂质合成与提纯工艺,采用先进的多步合成+高压液相纯化技术,确保DPPC纯度>99%、磷脂酰胆碱比例精准可控、残溶远低于药典标准。同时,公司建立了公斤级中试装置与批量放大生产线,能满足科研、中试与临床前开发的多层次需求,真正实现从实验室到产业化的无缝衔接。
2. 定制化载体工艺开发服务
针对抗菌药物、口腔制剂及脂质体递送系统等应用需求,中新康明提供DPPC载体处方筛选、脂质比例优化、包封率提升与释放曲线调控等系统开发服务。
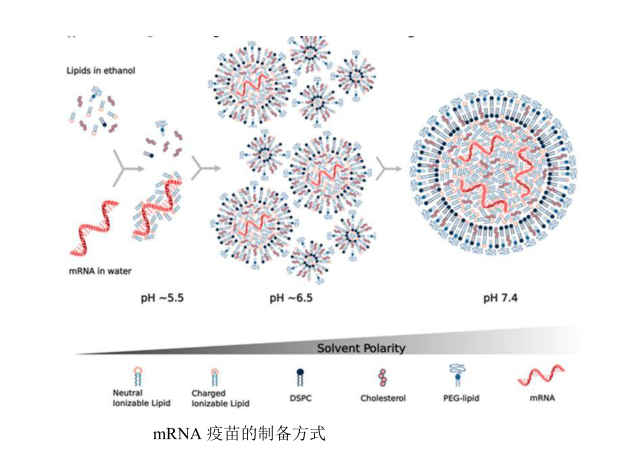
对于小分子抗菌剂或天然活性物质,公司可通过膜流动性调控与表面电荷调整,提高药物包载与释放性能;
对于联合脂质体(如DPPC/DOTAP或DPPC/DSPC体系),可通过实验设计(DoE)优化粒径分布与膜稳定性,确保在口腔环境中的高效释放。
3. 中试放大与工艺验证
中新康明拥有完善的脂质体工艺放大平台,涵盖高压均质、薄膜水化、微流控混合等多种技术路线。针对DPPC体系的特殊相行为,公司积累了丰富的放大参数与稳定性验证经验,可帮助客户快速实现从克级到公斤级的规模跃迁,确保产品在中试及GMP条件下的可复制性。
4. 质量与法规支持体系完善
公司产品符合欧盟与美国药典标准(EP/USP),提供全套分析报告(含HPLC、NMR、DSC、GC-MS检测),并配备质量追溯体系与批次一致性验证服务,为药企及研究机构的注册申报提供有力数据支持。
三、结语
DPPC作为经典而高性能的磷脂原料,正在从基础药物递送研究拓展至抗菌与口腔生物医学应用领域。在抗牙龈卟啉单胞菌研究中,DPPC不仅能构建稳定的脂质体屏障,还能协同增强抗菌药物的膜作用,实现高效、温和、可控的抗感染效果。
凭借公斤级生产能力、成熟的工艺开发体系与中试放大经验,中新康明正成为国内外科研机构与制药企业信赖的脂质原料与载体技术合作伙伴。未来,中新康明将继续推动包括DPPC在内的功能脂质材料在抗菌、疫苗、mRNA递送及靶向治疗等领域的产业化应用,为全球生命科学与健康产业提供更高质量、更可持续的解决方案。
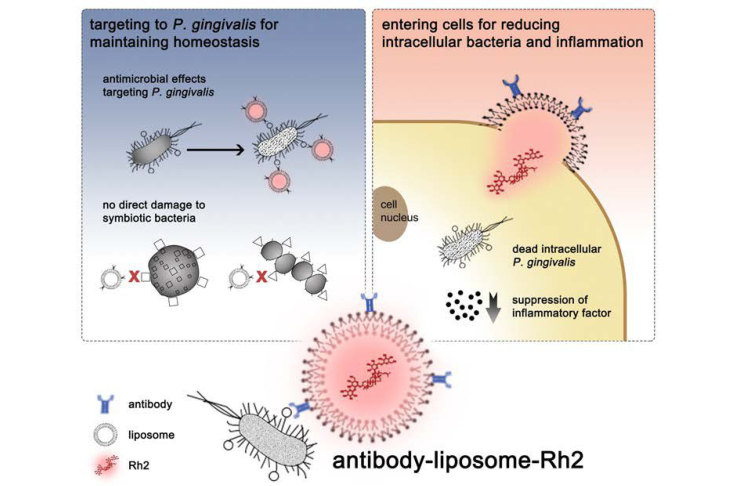
引用文献:“抗牙龈卟啉单胞菌的脂质体—人参皂苷Rh2的制备及其在牙周炎治疗中的研究”
关键词:牙周炎;靶向治疗;抗体偶联;脂质体人参皂苷Rh2;牙龈卟啉单胞菌;
专辑:医药卫生科技
专题:口腔科学
DOI:10.27379/d.cnki.gwhdu.2023.000068
节选:结果:脂质体主要由胆固醇和磷脂构成,具有类细胞膜的结构。在本研究中,最终选用胆固醇、二棕榈酰磷脂酰胆碱(dipalmitoilfosfatidilcolina,DPPC)和马来酰亚胺-聚乙二醇-二硬脂酰磷脂酰乙醇胺(1,2-distearoyl-sn-glycero-3-phosphoethanolamine-N-[maleimide(polyethylene glycol)-2000],mal-PEG-DSPE)制作聚乙二醇(polyethylene glycol,PEG)化脂质体。将制备的脂质体与Rh2孵育,得到L-R。采用正交实验方法根据载药量和包封率确定胆固醇、DPPC和mal-PEG-DSPE的比例。当胆固醇、DPPC、mal-PEG-DSPE和Rh2的摩尔比为2:2:10:1时,L-R的载药量为78.86%,包封率为20.69%。MIg G1和MIg G2a均有效靶向牙龈卟啉单胞菌,MIg G1的敏感性比MIg G2a略高。而后使用MIg G1制备A-L-R。在纯脂质体和A-L-R的FTIR光谱中,均可见磷脂酰胆碱脂肪的脂肪链反对称振动和对称振动,意味着抗体成功偶联到脂质体上且没有破坏其特征峰。FTIR检测确认成功将Rh2包裹在脂质体中并成功结合抗体,脂质体结构未被破坏。A-L-R在水溶液中的粒径小于100 nm,zeta电位为-3.78 m V。TEM观察可见,经100 nm滤膜过滤压缩后的A-L-R直径约为52.99 nm,表面略粗糙,与脂质体具有相似的特征(脂质体直径约为44.94 nm,表面略粗糙)。A-L-R具有良好稳定性,除了在碱性环境下会沉淀,在高温、低温、强光、强酸、强氧化等环境下均维持稳定包封率。结论:在本研究中,成功制备了具有较佳载药量与包封率的A-L-R。A-L-R保有脂质体的基本结构且成功包裹Rh2、偶联抗体。A-L-R粒径小于100 nm,具有良好稳定性。
 返回
返回