随着核酸药物与mRNA疫苗的快速发展,脂质纳米颗粒(LNPs)已成为最重要的体内递送系统。其中,SM-102、ALC-0315和MC3是应用最为广泛的代表性可电离脂质。中新康明可根据药物类型(mRNAvssiRNA)、适应症(急性感染vs慢性疾病)和研发目标(免疫激活vs长效安全)来选择最优脂质平台,以提高研发效率并降低风险。下面,中新康明就根据三种不同的脂质递送材料的优劣势进行分析,助力做出更适合的的解决方案。
在核酸药物和 mRNA 疫苗快速发展的今天,脂质纳米颗粒(LNPs) 已成为递送系统的核心平台。不同的可电离脂质在 药代动力学、安全性、递送效率和适应症方面各具优势。为了帮助研发团队更快完成从实验室研究 → 临床前 → 临床转化的全过程,中新康明提供基于SM-102、ALC-0315 和 MC3 的专业化服务。
1.SM-102:均衡型脂质,擅长mRNA药物的安全与稳定递送
优势表现
药代动力学均衡:SM-102在生理pH下电中性,减少血液中非特异性结合和快速清除,延长体内循环时间。
组织分布合理:在肝脏蓄积较低,同时在肌肉和淋巴组织中维持时间较长,适合疫苗和局部治疗。
可预测代谢:酯键结构可被体内酯酶水解,代谢途径清晰,毒性低。
处方可调控性:通过调节LNP配方中SM-102的比例,可以精准改变半衰期和生物分布。
更擅长的方向:mRNA疫苗与蛋白替代疗法。SM-102在表达效率和安全性之间达到平衡,适合需要长期可预测递送的药物开发。
中新康明提供SM-102服务——均衡型递送,适合mRNA疫苗与蛋白替代疗法
适用方向:mRNA 疫苗,蛋白替代疗法(罕见病、慢性病)
服务内容:SM-102 LNP 定制配方开发、临床前 PK/PD 研究、GLP 合规毒理与安全性研究、IND 申报支持
2.ALC-0315:高效型脂质,擅长疫苗和免疫治疗
优势表现
递送效率高:ALC-0315结构设计增强了mRNA的递送能力,在细胞摄取和表达方面表现突出。
快速免疫激活:在临床前模型中表现为强效免疫原性,能够快速诱导免疫反应。
已有验证:辉瑞/BioNTech新冠疫苗的成功,为ALC-0315提供了充分的动物与人群安全性和有效性数据。
不足与局限
部分研究提示炎症反应较强,局部反应和系统性炎症可能高于SM-102。
合成路线较复杂,放大生产难度相对大。
更擅长的方向:疫苗与免疫治疗。ALC-0315特别适合需要快速高效免疫应答的适应症,如传染病疫苗和肿瘤免疫治疗。
中新康明提供ALC-0315脂质服务——高效型递送,适合疫苗与免疫治疗
适用方向:传染病疫苗、肿瘤免疫治疗
服务内容:高效 ALC-0315 LNP 配方筛选、动物模型免疫原性测试、毒理学与炎症反应评估、疫苗开发全流程 CRO 支持。
3.MC3:安全型脂质,擅长siRNA与基因沉默类药物
优势表现
代谢途径清晰:MC3是FDA批准的第一个用于siRNA药物(Onpattro)的可电离脂质,其代谢与安全性数据积累最为丰富。
毒性低:酯键可水解,代谢产物安全,临床前毒理学数据充分。
工艺成熟:MC3已经建立较为成熟的制备和分析方法,易于工业放大。
不足与局限
对mRNA的递送效率不如SM-102和ALC-0315。
在疫苗和蛋白替代疗法中应用有限。
更擅长的方向:siRNA药物和基因沉默疗法。MC3在RNAi药物领域是“黄金标准”,适合需要长期安全递送的慢性疾病治疗。
中新康明提供MC3脂质服务 —— 安全型递送,适合 siRNA 与基因沉默疗法
适用方向:siRNA 药物、基因沉默类疗法、慢性疾病的长期给药方案
服务内容:MC3 siRNA LNP 定制与处方优化、GLP 毒理与长期安全性评估、PK/PD 与生物分布建模、工艺放大与 CMC 支持
阶段 | MC3 | SM-102 | ALC-0315 |
早期发现 | ✅siRNA递送验证充分 ✅安全性数据积累多 ❌mRNA递送效率有限 | ✅高效递送mRNA,适合早期验证 ✅动物模型效果突出 ❌专利限制,材料获取有限 | ✅已在人用疫苗验证递送效率 ✅强免疫应答 ❌合成工艺复杂,研发可及性差 |
临床前研究 | ✅安全性高,代谢途径清晰❌ mRNA翻译效率不足 | ✅药代表现均衡(分布+代谢) ✅可通过处方优化提升效果 ❌肝脏蓄积仍需关注 | ✅强免疫激活能力 ✅毒理安全性可接受 ❌炎症风险较高 |
临床阶段 | ✅Onpattro已获批,临床经验丰富 ❌尚无mRNA成功案例 | ✅Moderna疫苗应用,全球大规模验证 ✅丰富的人体安全性和PK数据 ❌专利绑定Moderna | ✅辉瑞/BNT疫苗应用,数十亿剂次验证 ✅临床安全性数据库庞大 ❌局部不良反应率较高 |
产业化/商业化 | ✅工艺成熟 ✅专利逐步解禁 ❌市场范围主要局限于siRNA | ✅成熟供应链,支持全球化生产 ✅mRNA领域的“黄金标准” ❌供应链依赖单一渠道 | ✅已实现大规模生产与分发 ✅疫苗商业化经验丰富 ❌工艺复杂、成本高 |
总结
SM-102:均衡型脂质,兼顾效率与安全性,最适合mRNA疫苗和蛋白替代疗法。
ALC-0315:高效型脂质,递送和免疫应答最强,最适合疫苗和免疫治疗。
MC3:安全型脂质,代谢清晰、毒性低,最适合siRNA药物与基因沉默疗法。
参考文献1:
“新型可电离脂质的制备及其在mRNA递送中的应用”
关键词:mRNA递送载体脂质纳米颗粒制备工艺免疫治疗
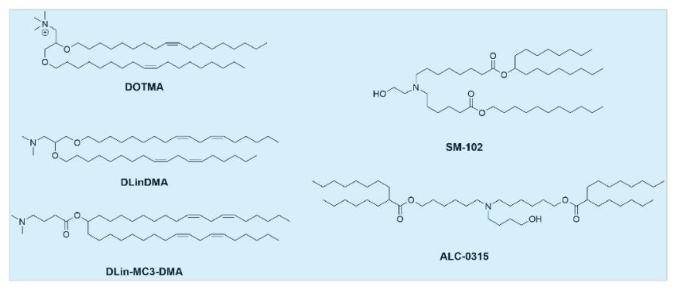
将阳离子脂质头部的季胺更换成叔胺基团得到可电离脂质,这种脂质在生理pH下呈中性。与阳离子脂质相比,这一特性提高了它们的安全性并延长了循环时间,降低了载体的毒性。可电离脂质在酸性缓冲液中带正电,并能够有效负载mRNA,形成纳米颗粒。此外,它们在核内体的酸性环境中带正电荷,促进纳米粒与核内体膜融合,并将其释放到细胞质中。为提高疗效,研究人员在DODMA的基础上开发了DLinDMA,并最终优化得到DLin-MC3-DMA,后者在FDA批准的LNP配方中应用于小干扰RNA药物(Onpattro)。除了能够有效、安全地递送SiRNA以外,DLin-MC3-DMA在mRNA递送中也发挥了重要功能。
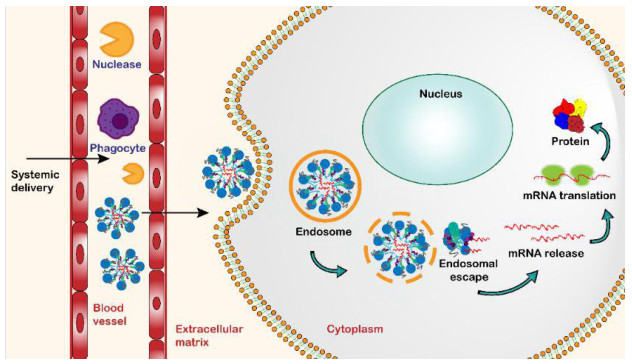
虽然上述理性设计的脂质设计方法在某些情况下取得了成功,但由于mRNA递送的过程复杂,对脂质结构-效果之间关系的理解不足,脂质的开发相对缓慢。为了加速材料的发现,学术界和工业界的许多研究人员已经使用组合化学的策略来合成大量的潜在递送材料,通过高通量筛选获得高效递送载体。这种方法已经产生了许多有效脂质,包括C12-200、503013、3060i0、OF-02、TT3、5A2-SC8、SM-102(用于Moderna开发的新冠疫苗mRNA-1273)、ALC-0315(用于辉瑞-BioNTech开发的新冠疫苗BNT162b2)。此外,从高通量筛选的构-效关系数据中已经确定了能够预测疗效的因素,包括脂质关键pK和溶血活性等,能够用于指导新型mRNA脂质载体的设计。
参考文献2:
“新型可电离阳离子脂质的合成及其用于mRNA递送的研究”
关键词:新型可电离脂质;脂质纳米粒;微流控;递送效果;
DOI:10.27170/d.cnki.gjsuu.2024.001886
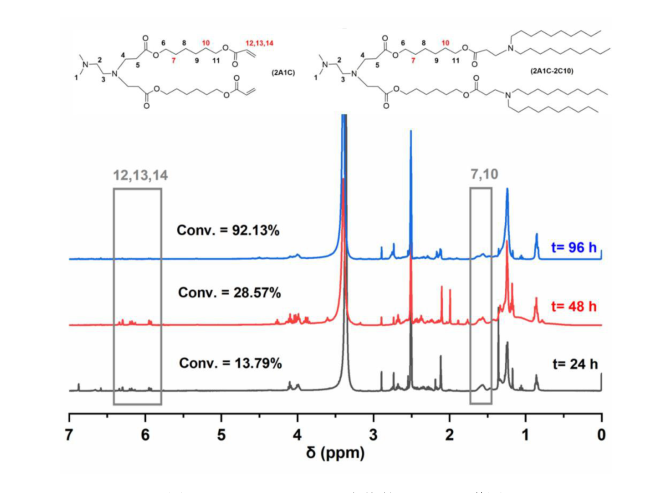
摘要:近年来,核酸药物在临床应用中显示出良好的应用前景。其中,mRNA药物由于其不需要进入细胞核,在细胞质中即可表达出蛋白发挥作用,因此较DNA药物具有更好的安全性。但由于其分子量较大、易被核糖核酸酶降解等原因,导致其体内应用必须借助合适的递送载体。理想的递送系统需同时满足以下几个条件:在到达靶点前,可对mRNA进行有效包封和保护;可提高mRNA进入细胞的效率;在mRNA进入溶酶体后,可协助mRNA从溶酶体中逃逸,将其释放到细胞质。目前主流的mRNA递送载体为脂质纳米粒(LipidNanoparticles,LNPs),一般包含四个组分:可电离脂质、辅助型脂质、胆固醇以及聚乙二醇化(PEG)磷脂。已上市的可电离脂质包括SM-102、ALC-0315、MC3等,由于其在mRNA递送中的核心作用,已申报相当数量的相关专利。因此,开发出具有良好递送效果的新型可电离脂质显得尤为重要。鉴于此,我们根据可电离脂质的基本结构(可电离的胺基头、疏水尾以及中间的连接键三部分),设计出两种新型可电离脂质S-1、S-2,分别含有两条和三条疏水链,并均以胆固醇为其中一条疏水链。本课题以S-1或S-2作为可电离脂质,制备脂质纳米粒,并对其递送效果进行体内外表征。具体内容如下:一、设计并合成两种新型可电离脂质—S-1、S-2。可电离脂质S-1、S-2均以可电离的叔胺作为亲水头,以酰胺键充当连接键。S-1携带包含胆固醇在内的两条疏水链,而S-2携带三条疏水链。这样的结构设计,有利于驱动磷脂双分子层脂质膜从双层结构到倒置六方形的转变,促进溶酶体逃逸及mRNA在细胞质中的表达。合成了S-1、S-2,经柱层析色谱对合成出的产物进行纯化。通过核磁共振谱(1H-NMR、13C-NMR)、红外光谱(IR)对S-1、S-2的特征官能团进行表征,通过质谱(MS)对其分子量进行表征,结果显示S-1的分子量为725,S-2的分子量为811。
 返回
返回