一、肝癌治疗现状与纳米递送技术的新机遇
肝细胞癌(Hepatocellular carcinoma,HCC)是全球范围内发病率和死亡率均居前列的恶性肿瘤之一。由于肝癌起病隐匿、进展迅速,且多数患者确诊时已处于中晚期,传统化疗药物在临床应用中面临疗效有限、系统毒副作用大以及肿瘤耐药等多重挑战。
紫杉醇(Paclitaxel,PTX)作为经典的广谱抗肿瘤药物,在多种实体瘤治疗中展现出良好的抑制肿瘤细胞增殖作用,但其水溶性差、生物利用度低、体内分布非特异性,严重限制了其在肝癌治疗中的应用潜力。如何通过新型递送系统实现紫杉醇在肿瘤部位的精准富集与可控释放,已成为当前纳米医学研究的重要方向之一。
肿瘤微环境与正常组织在理化特性上存在显著差异,其中酸性微环境(pH 4.5–6.8)是实体瘤最具代表性的特征之一。基于此,构建对 pH 变化高度敏感的纳米载体体系,使药物在肿瘤局部选择性释放,被认为是提高抗肿瘤疗效、降低系统毒性的有效策略。
二、漆酚基 pH 响应型 BPAU-NH2-Gal 纳米胶束的研究进展
近期研究以5-氨基-1-戊醇、1,4-丁二醇二丙烯酸酯(BUDA)和胺基官能化甲氧基聚乙二醇(mPEG-NH2)为基础原料,通过自组装方式构建了传统 pH 敏感型胶束 BUDA-P(mPEG-NH2)(BPAU)。在此基础上,引入三烯漆酚苯硼酸胺衍生物(URU-NH2)作为疏水单元,并进一步接枝半乳糖(Gal)识别基团,成功制备了具有主动靶向能力的 pH 响应型纳米胶束 BPAU-NH2-Gal。
该体系充分融合了多重设计优势:
pH 响应性结构设计:在酸性肿瘤微环境中发生质子化,引起胶束膨胀并促进药物释放;
漆酚衍生物疏水内核:增强对疏水性抗肿瘤药物紫杉醇的包载能力;
半乳糖靶向修饰:可被肝癌细胞表面的 ASGPR 受体特异性识别,提高 HepG2 细胞摄取效率。
通过透析法构建的 PTX@BPAU-NH2-Gal 纳米载药胶束在理化性质和体外生物学性能方面均表现出良好结果:
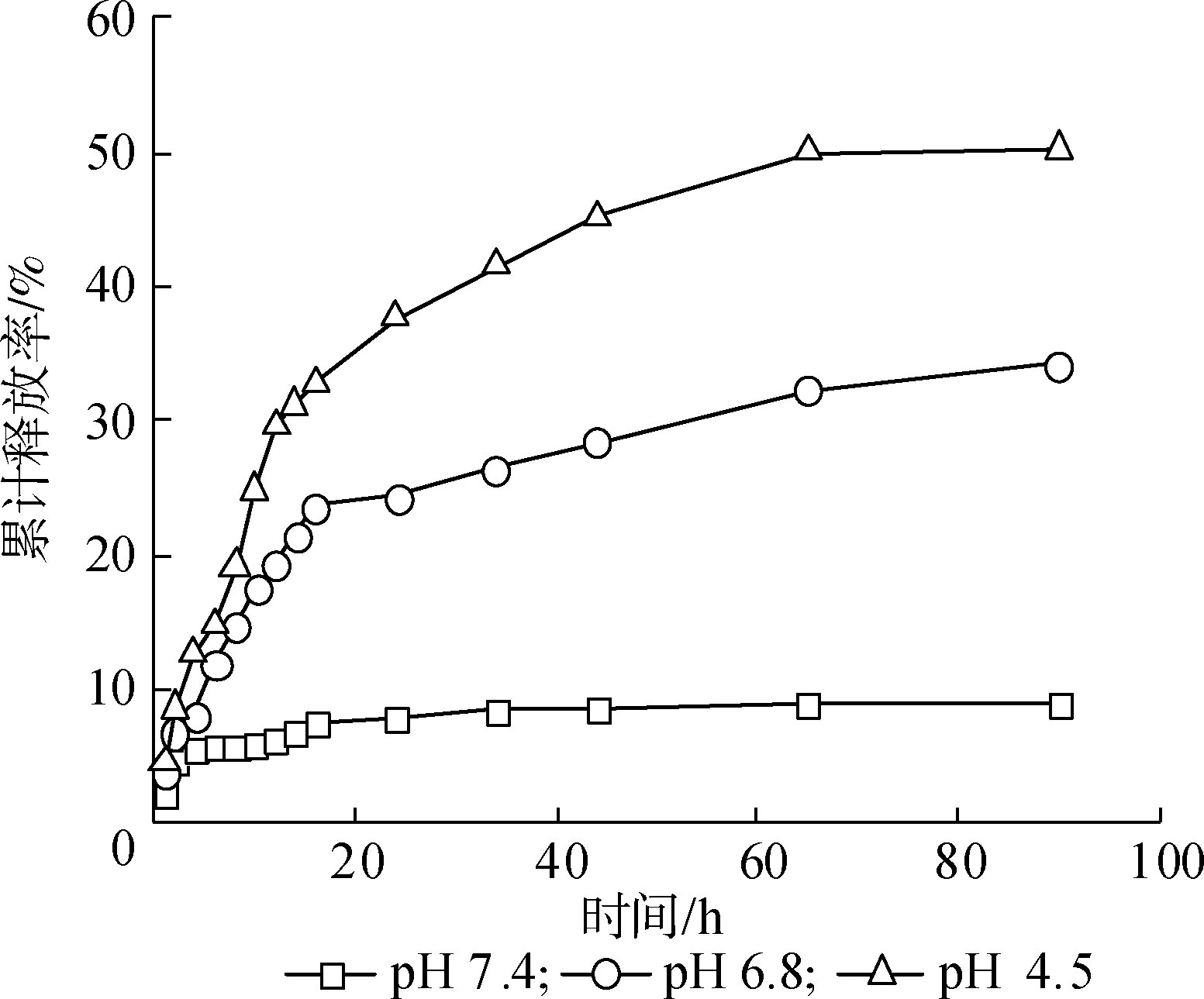
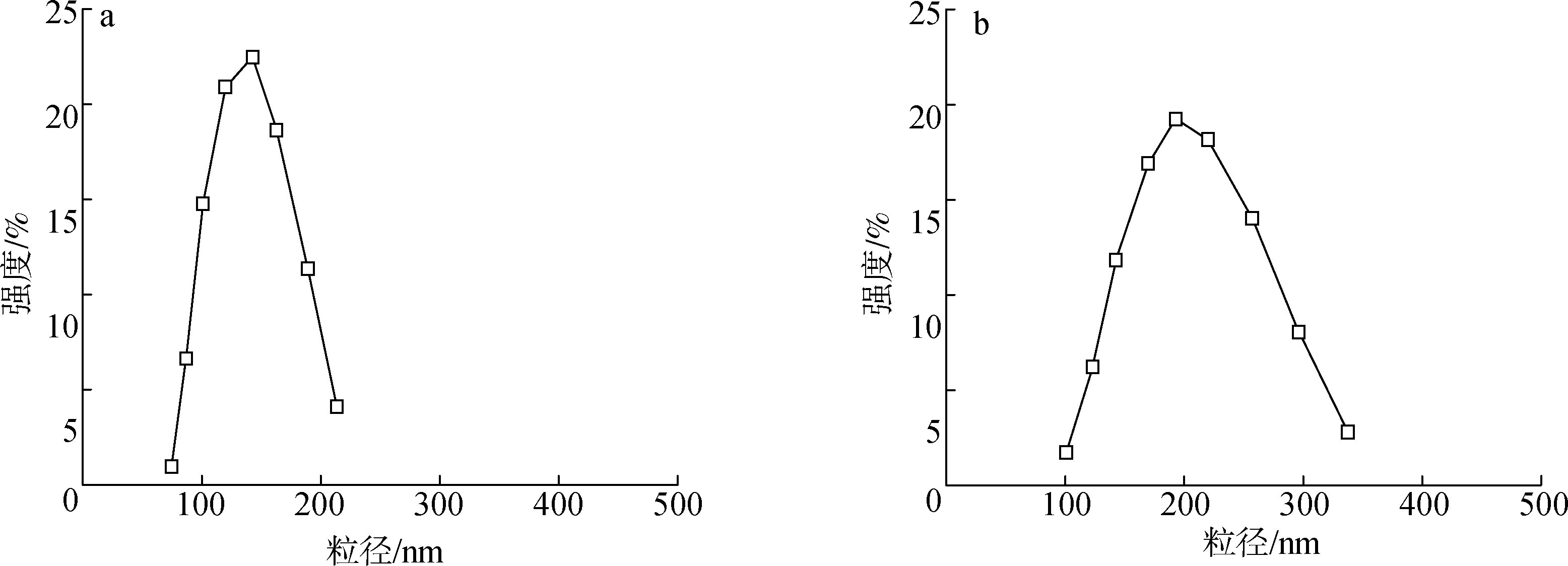
胶束平均粒径约 195 nm,适于通过 EPR 效应在肿瘤组织中被动富集;紫杉醇包封率高达 92.51%,载药量达 31.76%;在 pH 4.5 条件下的药物释放显著高于中性环境,呈现出明确的 pH 触发释放行为。同时,该体系对正常肝细胞 LO2 表现出较低细胞毒性,而在酸性条件下对 HepG2 细胞具有显著增强的摄取能力,体现了良好的肿瘤选择性。
三、中新康明在纳米载体药物开发中的原料与 CDMO 支持
围绕 pH 响应型纳米胶束及紫杉醇等疏水药物递送体系的研发需求,中新康明可为科研机构及药物研发企业提供覆盖“原料—制剂—检测—优化”全流程的非-GMP 级 CDMO 服务支持。
在原料层面,中新康明可稳定供应并支持定制化开发:
胺基官能化甲氧基聚乙二醇(mPEG-NH2)
BUDA-P(mPEG-NH2) 及相关聚合物中间体
pH 响应型纳米胶束体系(BPAU-NH2-Gal)
紫杉醇纳米载药胶束(PTX@BPAU-NH2-Gal)
上述原料与体系均可用于早期探索性研究、处方筛选及机制验证阶段,帮助客户在非-GMP 条件下高效推进项目进度,降低研发成本。
四、BPAU-NH2-Gal 纳米胶束的制备与数据检测 CDMO 能力
针对漆酚基 pH 响应型纳米胶束负载紫杉醇的开发路径,中新康明可提供以下关键技术服务:
1. 纳米胶束制备与载药工艺开发
自组装与透析法制备载药胶束
疏水药物包载条件优化
处方参数筛选与放大可行性评估
2. 理化结构与质量表征
NMR(¹H / ¹³C)结构解析
GPC 测定 Mw、Mn 与 PDI
CMC 测定与胶束稳定性分析
DLS 粒径分布与 Zeta 电位检测
TEM 胶束形貌表征
3. 药物包载与释放性能评价
HPLC 测定包封率与载药量
不同 pH 条件下的体外释放曲线
数据整理与对比分析支持
4. 体外生物学评价支持(科研阶段)
细胞毒性初筛(如 LO2、HepG2)
肿瘤细胞摄取实验设计支持
荧光标记胶束示踪方案建议
五、相关案例:pH 响应型纳米胶束在抗肿瘤研究中的应用
在多个抗肿瘤纳米递送项目中,中新康明已协助客户完成从功能化聚合物合成、纳米胶束构建、疏水药物包载到系统理化表征与体外释放验证的一体化研发支持。漆酚基 BPAU-NH2-Gal 紫杉醇载药胶束体系的研究,正是此类平台能力在肝癌靶向递送方向上的典型体现,为后续多药物、多靶点纳米载体设计提供了可借鉴的技术路线。
六、总结:以 CDMO 平台赋能纳米药物研发效率
随着肝癌治疗向精准化、微环境响应型方向不断发展,pH 敏感型纳米载体在抗肿瘤药物递送中的价值日益凸显。中新康明将持续围绕纳米载体药物、功能高分子与递送系统,提供从非-GMP 原料供应到制剂工艺开发、数据检测与技术转化支持的综合 CDMO 服务,助力科研成果高效迈向应用阶段。
 返回
返回