随着肿瘤免疫治疗技术的飞速发展,基于RNA干扰与细胞因子协同作用的新型纳米药物正成为攻克非小细胞肺癌(NSCLC)的重要突破口。近日,一项发表于《AIPAdvances》的研究成果显示,由聚乙烯亚胺(PEI)修饰的脂质纳米颗粒(PEI-LNPs)共载PD-L1-siRNA与IL-2质粒DNA,可显著激活T细胞功能、下调肿瘤细胞PD-L1表达,并重塑免疫微环境,为肺癌靶向免疫治疗开辟了全新路径。
作为国内领先的CDMO(合同研发生产组织)服务商,中新康明始终聚焦前沿药物递送系统,尤其在核酸药物纳米载体领域积累了深厚的技术储备与产业化经验。针对上述研究中所涉及的PEI-LNPs平台,中新康明现已全面开放非GMP级别原料供应、配方优化、理化表征及体外功能验证等一站式CDMO服务,助力科研机构与创新药企加速从“实验室”走向“临床”。
一、PEI-LNPs:肺癌免疫治疗的新一代纳米载体
传统化疗与靶向治疗虽在肺癌治疗中取得一定成效,但耐药性与免疫逃逸仍是临床难题。PD-L1作为关键免疫检查点分子,其高表达可抑制T细胞活性,帮助肿瘤逃避免疫监视。而IL-2作为强效T细胞生长因子,能促进效应T细胞扩增,但全身给药易引发严重毒性。
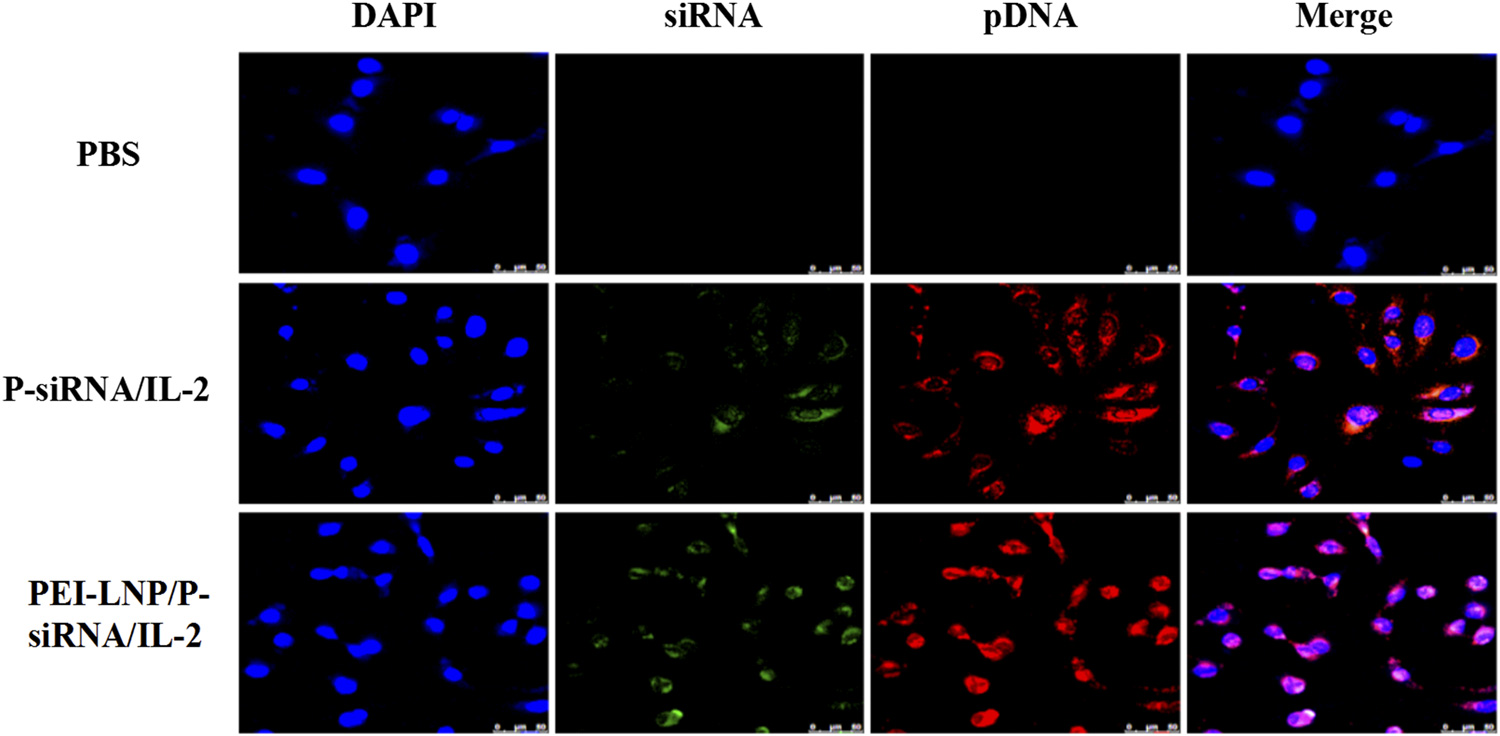
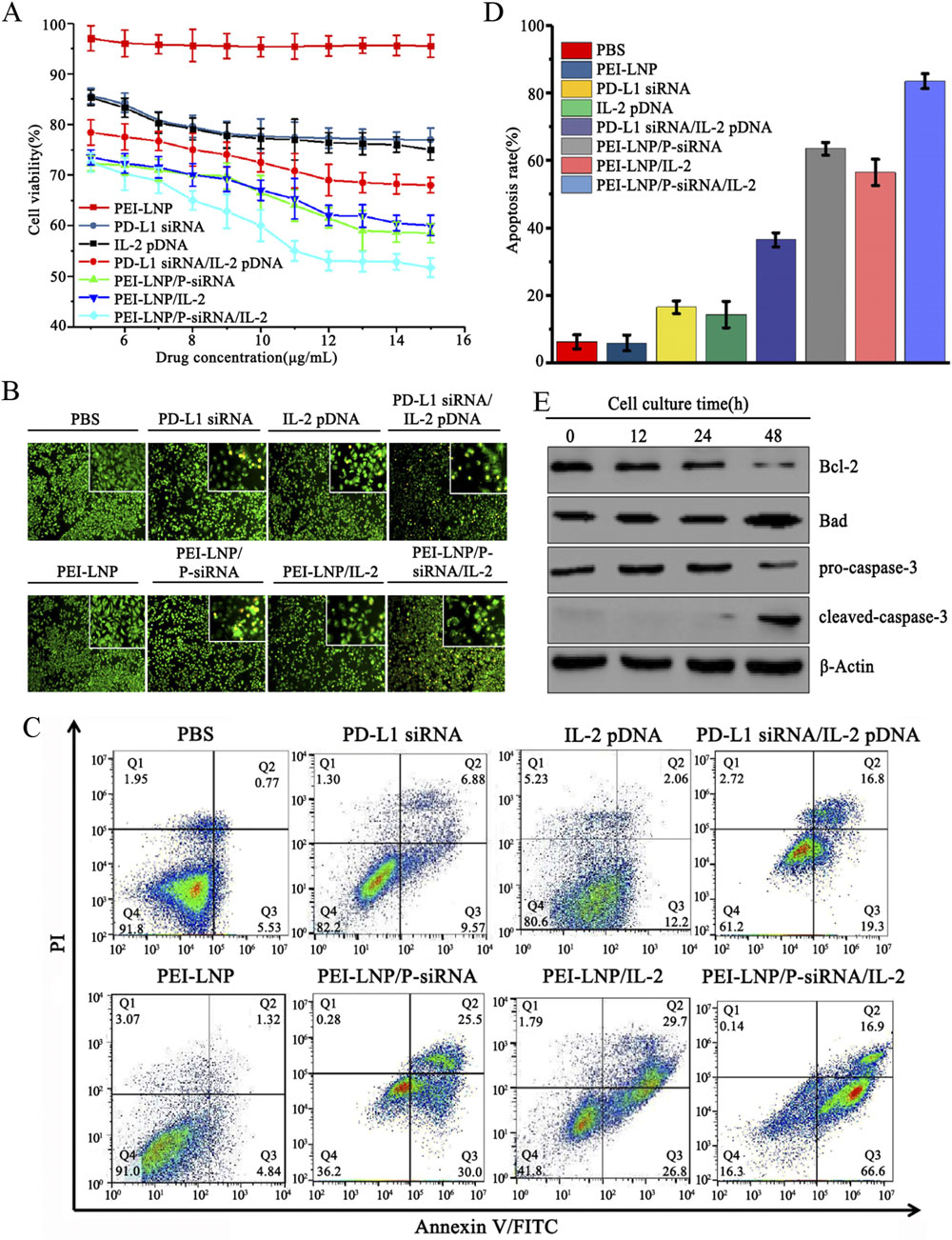
该研究巧妙地将PD-L1-siRNA(沉默免疫抑制信号)与IL-2pDNA(局部激活免疫应答)共封装于PEI-LNPs中,实现“双管齐下”的协同治疗策略。实验表明,该复合纳米颗粒平均粒径约137.5nm,带正电荷,具备优异的核酸负载能力(最高达86μg/mg),且在酸性肿瘤微环境中可高效释放药物。更重要的是,其在A549肺癌细胞中显著下调PD-L1表达,同时诱导IFN-γ和TNF-α分泌增加、IL-10水平下降,有效逆转免疫抑制状态,凋亡率高达83.5%。
这一成果不仅验证了PEI-LNPs作为多功能核酸递送平台的巨大潜力,也为后续开发“肿瘤微环境响应型”、“T细胞定向激活型”纳米药物提供了重要范式。
二、中新康明:提供全链条PEI-LNPs CDMO解决方案
为支持此类前沿研究快速转化,中新康明现已面向高校、科研院所及Biotech公司,提供非GMP级PEI-LNPs药物开发的全套CDMO服务,包括:
高纯度原料供应:提供分子量2000的支化PEI、DOPC、胆固醇、mPEG-OH、PEI-硬脂酸(PEI-SA)等核心脂质材料,符合科研级标准;
纳米制剂定制开发:基于反相乳化-超声法制备PEI-LNPs,可灵活调控siRNA/pDNA载量、粒径分布(80–200nm)及Zeta电位(+20至+40mV);
全面理化表征:配备Malvern Zetasizer Nano ZS、透射电镜(TEM)、傅里叶红外光谱(FT-IR)、UV-Vis分光光度计等设备,提供粒径、电位、包封率、载药量、体外释放曲线(pH6.0/7.4)等关键数据;
体外功能评价:支持MTT细胞毒性、AO/PI荧光染色、流式细胞术凋亡分析、WesternBlot蛋白表达检测及ELISA细胞因子定量等服务。
三、技术优势:安全、高效、可放大
中新康明在PEI-LNPs开发中具备三大核心技术优势:
低毒性PEI修饰技术:通过将PEI与硬脂酸共价偶联(PEI-SA),显著降低游离PEI的细胞毒性,同时保留其“质子海绵效应”,提升内体逃逸效率;
双核酸共载平台:独创siRNA与pDNA协同装载工艺,确保两种不同性质核酸在同一载体中的稳定共存与可控释放;
模块化CDMO流程:从处方筛选到中试放大,均采用标准化操作规程(SOP),确保数据可重复、工艺可转移,为后续IND申报奠定基础。
四、成功案例:支持多项国家级科研项目
截至目前,中新康明已为包括中科院某研究所、华东某顶尖医学院及多家创新药企提供PEI-LNPs相关CDMO服务。其中,某客户基于我司提供的PEI-SA/DOPC/Chol配方体系,成功构建了靶向EGFR突变肺癌的siRNA-LNPs,在PDX模型中实现肿瘤体积抑制率达70%,相关成果正在准备发表于国际知名期刊。
五、中新康明CDMO服务:赋能核酸药物从0到1
作为专注于高端药物递送系统的CDMO平台,中新康明不仅提供PEI-LNPs服务,还覆盖LNP、聚合物胶束、外泌体、病毒样颗粒(VLP)等多种递送系统。公司拥有万级洁净实验室、GMP中试车间及完整的质量控制体系,可提供从早期研发、工艺开发、分析方法建立、稳定性研究到临床样品制备的全生命周期服务。
我们坚信,以PEI-LNPs为代表的智能纳米载体,将成为下一代肿瘤免疫治疗的核心引擎。中新康明愿以专业、高效、合规的服务,与全球科研与产业伙伴携手,共同推动中国原创核酸药物走向世界舞台。
 返回
返回